
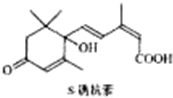
 对盆栽鲜花施用S-诱抗素制剂,可以保持鲜花盛开.S-诱抗素的分子结构如图,则1mol该物质与足量的NaOH溶液反应时最多可消耗NaOH的物质的量为( )
对盆栽鲜花施用S-诱抗素制剂,可以保持鲜花盛开.S-诱抗素的分子结构如图,则1mol该物质与足量的NaOH溶液反应时最多可消耗NaOH的物质的量为( )| A、1mol | B、2mol |
| C、3mol | D、4mol |
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
| A | A的最高价氧化物对应的水化物化学式为H2AO3 |
| B | B元素的第一电离能比同周期相邻两个元素都大 |
| C | C原子在同周期原子中半径最大(稀有气体除外),其单质焰色为黄色 |
| D | D的基态原子最外层电子排布式为3s23p2 |
| E | E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 陈述I | 陈述Ⅱ |
| A | 向酚酞溶液中加Na2O2,溶液先变红后褪色 | 向石蕊溶液中通入Cl2,溶液先变红后褪色 |
| B | 将SO2和Cl2同时通入BaCl2溶液中,产生白色沉淀 | 将CO2和NH3同时通入CaCl2溶液中,产生白色沉淀 |
| C | 向MgCl2溶液中加入NaOH溶液生成白色沉淀 | 向FeCl3溶液中加入NaOH溶液生成红褐色沉淀 |
| D | Na投入水中产生大量气泡 | Na2CO3投入盐酸中产生大量气泡 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、布朗运动就是液体分子的热运动 |
| B、对一定质量的气体加热,其内能一定增加 |
| C、物体的温度越高,分子热运动越剧烈,分子的平均动能越大 |
| D、分子间的引力与斥力同时存在,斥力总是小于引力 |
查看答案和解析>>
科目:高中化学 来源: 题型:
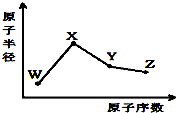 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高正价和最低负价之和为0;Z的非金属性在同周期元素中最强.下列说法正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高正价和最低负价之和为0;Z的非金属性在同周期元素中最强.下列说法正确的是( )| A、对应气态氢化物的稳定性:Y>Z |
| B、化合物XZW既含离子键也含共价键 |
| C、对应简单离子半径:W>X |
| D、Y的氧化物能与Z或X的最高价氧化物对应的水化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若B为强碱,则A一定为金属钠 |
| B、若B为强酸,则A一定为氯气 |
| C、若C为H2,则H2O一定作氧化剂 |
| D、若C为O2,则H2O一定作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4能从中萃取出碘 |
| B、制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只要将溶液蒸干即可 |
| C、用移液管取液后,将移液管稍倾斜放入垂直的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 |
| D、当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X的单质和Q的单质均可用电解法得到 |
| B、X与Z可形成同时含有极性键和非极性键的化合物 |
| C、Q与W形成的化合物熔化或溶于水时均可发生电离 |
| D、X、Y、Z三种元素形成的化合物一定能抑制水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com