
【题目】电解CuCl2和NaCl的混合溶液,阴极和阳极上分别析出的物质是( )
A. H2和Cl2 B. Cu和Cl2 C. H2和O2 D. Cu和O2
科目:高中化学 来源: 题型:
【题目】把石灰石浸入盐酸中,下列措施能使反应速率增大的是
①加大盐酸用量 ②增大盐酸浓度 ③粉碎石灰石 ④增大体系压强
A.①③ B.②③ C.①④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制取氯酸钾的主要步骤为:
I.将Cl2通入石灰浆,在75℃左右充分反应,然后过滤;
II.向滤液中加入稍过量的KCl固体,进行适当操作可析出KClO3固体。
请回答下列问题:
(1)步骤I中总反应的化学方程式为6Ca(OH)2+ 6Cl2=Ca(ClO3)2+5CaCl2+ 6H2O 。
①标出反应中电子转移的方向和数目______________。
②滤液中Ca(ClO3)2与CaC12的物质的量之比n[Ca(ClO3)2]:n [CaCl2]____l∶5 (填“> ”“< ”、或“=” ) ,理由是___________。
(2)下图是有关物质的溶解度曲线。步骤II中,若溶液中KClO3的含量为147g·L-1,则KClO3得物质的量浓度为_______________。从该溶液中尽可能多地析出KClO3 固体的方法是______________。
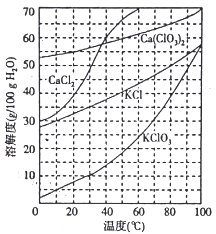
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用氟硅酸钠(Na2SiF6)生产冰晶石(Na3AlF6)的工艺流程如下:
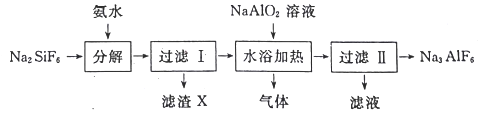
(1)分解过程发生的反应为:Na2SiF6+4NH3H2O═2NaF+4NH4F+X↓+2H2O。工业上把滤渣X叫白炭黑,其化学式为______________________。
(2)分解时白炭黑产率和冰晶石纯度与pH的关系如图所示,分解时需要控制溶液的pH=________;能提高其分解速率的措施有___________ (填标号)。
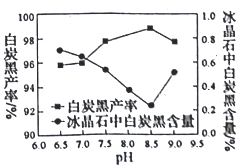
A.快速搅拌B.加热混合液至100℃C.降低氨水浓度
(3)流程中可循环利用的物质为_________(写化学式);冰晶石在电解冶炼铝中的作用是降低氧化铝的熔融温度、________________________和提髙产率。
(4)水浴加热过程中生成冰晶石的化学方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳呼吸电池”是一种新型能源装置,其工作原理如图所示。下列有关说法中错误的是
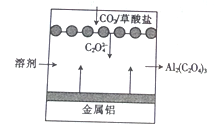
A. 该装置将化学能转变为电能
B. 利用该技术可捕捉大气中的CO2
C. 该装置工作时,正极上的电极反应式为2CO2-2e-=C2O42-
D. 该装置工作时,理论上每生成1 mol 草酸铝,电路中通过6 mol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:A(气)+3B(气)![]() 2C(气) △H<0达平衡后,将气体混和物的温度降低,下列叙述中正确的是
2C(气) △H<0达平衡后,将气体混和物的温度降低,下列叙述中正确的是
A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动
C.正反应速率和逆反应速率都变小,平衡向正反应方向移动
D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四瓶未知溶液甲、乙、丙、丁,它们分别是K2SO3溶液、Ba(NO3)2溶液、NaHSO4溶液和K2SO4溶液中的一种.现进行如下实验,并记录部分现象(如图)。.已知气体c为纯净物且无色。
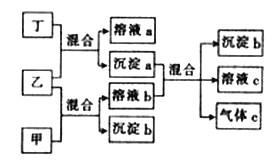
(1)写出下列溶液中溶质的化学式:甲__________,丁_________________。
(2)写出下列反应的离子方程式:
甲+乙:___________________________________。
沉淀a+溶液b:______________________________________。
(3)检验物质丙中阴离子的方法为_________________________(写出实验操作、现象等)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中,某化学反应:2A(g)![]() B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验 序号 |
| 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 900℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 900℃ | 1.0 | 0.60 | C2 | C2 | C2 | C2 | C2 |
3 | 900℃ | C3 | 0.77 | 0.65 | 0.55 | 0.45 | 0.40 | 0.40 |
4 | 920℃ | 1.0 | 0.90 | 0.77 | 0.67 | 0.60 | 0.60 | 0.60 |
根据上述数据,完成下列填空:
(1)在实验1,反应在20至30分钟时间内平均速度为________mol/(L·min)。
(2)在实验2,反应经20分钟就达到了平衡。则A的平衡浓度C2=________mol/L,你判断的依据是____________;对比实验1和实验2,实验2中隐含的反应条件是________。
(3)比较实验4和实验1,可推测该反应的△H________零。(填>、=、<)原因是:____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com