

| A.离子键 | B.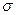  键 键 | C.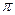 键 键 | D.氢键 E.配位键 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:实验题
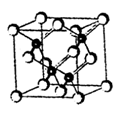
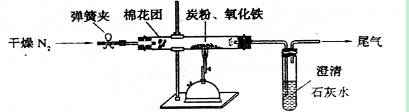
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.[Co(NH3)4]Cl3 | B.[Co(NH3)4Cl3] |
| C.[Co(NH3)4Cl]Cl2 | D.[Co(NH3)4Cl2]Cl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③④ | B.①②③ | C.②③④ | D.①③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元 素 | Mn | Fe | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
 与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 ;
与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 ;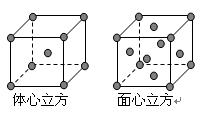
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | X | Y | Z |
| A | 混合物 | 胶体 | 分散系 |
| B | 纯净物 | 碱 | 纯碱 |
| C | 化合物 | 电解质 | BaSO4 |
| D | 化学反应 | 非氧化还原反应 | 复分解反应 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.离子晶体中可能含有共价键,但不一定含有金属元素 |
| B.分子晶体中一定含有共价键 |
| C.非极性分子中一定存在非极性键 |
| D.对于组成结构相似的分子晶体,一定是相对分子质量越大,熔沸点越高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 经催化剂作用变成N2和CO
经催化剂作用变成N2和CO 2,此反应中三种元素第一电离能由小到大的顺序为 ,在这四种物质中含有极性键的非极分子内
2,此反应中三种元素第一电离能由小到大的顺序为 ,在这四种物质中含有极性键的非极分子内 键和
键和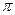 键的比为 。
键的比为 。| A.氢键 | B.离子键 | C.共价键 | D.配位键[E.范德华力 |
 对,则[Cu(NH3)n]+中n的值为
对,则[Cu(NH3)n]+中n的值为  。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CBr2F2 | B.CH3CH2OH |
| C.CH3CH2CH3 | D.CH3CH(OH)COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com