
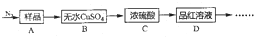
分析 Ⅰ.(1)晶体分解生成的产物中含水蒸气,B装置中无水硫酸铜遇到水蒸气会反应生成硫酸铜晶体呈蓝色,C装置是浓硫酸用来吸收碱性气体氨气或生成的三氧化硫,便于装置D利用品红溶液检验二氧化硫的存在;
(2)加热前先通一会儿N2,排净装置内的空气防止空气成分干扰气体检验;
Ⅱ.(3)生成产物制得三氧化硫、二氧化硫都是酸性氧化物和碱发生反应;
(4)生成的气体中含氨气、二氧化硫、三氧化硫等易溶于水的气体容易发生倒吸;
(5)根据溶液中Q与Ksp的关系分析;
(6)分解产物中当氨气和二氧化硫通入氯化钡溶液中互生成亚硫酸钡白色沉淀,检验三氧化硫可以检验生成的白色沉淀是否溶于盐酸;
解答 解:(1)晶体分解生成的产物中含水蒸气,无水硫酸铜遇到水蒸气会反应生成硫酸铜晶体呈蓝色,B装置中预期现象是白色硫酸铜变蓝色,C装置是浓硫酸用来吸收可能分解生成的碱性气体氨气或生成的三氧化硫,便于装置D利用品红溶液检验二氧化硫的存在,二氧化硫具有漂白性,可以使品红溶液褪色,
故答案为:变蓝,吸收NH3或SO3,SO2;
(2)加热前先通一会儿N2,再关闭气阀,其目的是利用氮气吧装置中空气全部赶出,防止空气中的水蒸气等干扰生成气体的检验,
故答案为:排出装置内的空气;
(3)不能选择E和F装置的原因是,装置中的氢氧化钡溶液是强碱溶液,碱石灰是氢氧化钠和氧化钙都可以和产物中的三氧化硫和二氧化硫气体,
故答案为:都能吸收SO3和SO2;
(4)加热装置A与G、H连接并进行实验,生成的气体中含氨气、二氧化硫、三氧化硫等易溶于水的气体容易发生倒吸,需要改进的方案是A、G之间增加防倒吸的装置,
故答案为:A、G之间增加防倒吸的装置;
(5)若溶液中c(Ba2+)=1 mol•L-1,c(SO32-)=6.0×10-8mol•L-1,其浓度积Q=c(Ba2+)×c(SO32-)=1×6.0×10-8=6.0×10-8<Ksp(BaSO3)=5.48×10-7,故不能析出BaSO3沉淀,
答:Q=1.0×6.0×10-8=6.0×10-8<Ksp(BaSO3),所以不能生成BaSO3沉淀;
(6)当G中出现大量白色沉淀时,并不能说明A中生成了SO3,理由是NH3和SO2同时通入BaCl2溶液中,能生成BaSO3白色沉淀,为了进一步证明是否有SO3生成,请你补充实验方案是:取白色沉淀于试管中,滴加过量的稀盐酸,若白色沉淀不溶解或部分溶解,则有SO3生成,若白色沉淀完全溶解,则没有SO3生成
故答案为:NH3和SO2同时通入BaCl2溶液中,能生成BaSO3白色沉淀,取白色沉淀于试管中,滴加过量的稀盐酸,若白色沉淀不溶解或部分溶解,则有SO3生成,若白色沉淀完全溶解,则没有SO3生成;
点评 本题考查物质分解产物的实验测定和实验检验方法分析判断,主要是气体性质、气体检验设计、溶度积应用等,侧重考查学生分析计算能力,需要学生具备扎实的基础与灵活应用能力,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3 NaCl NaOH | B. | KOH Na2CO3 HCl | ||
| C. | KNO3 NaOH FeCl3 | D. | AgNO3 BaCl2 HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、Y、Z的非金属性强弱顺序一定是Z>Y>W | |
| B. | W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z | |
| C. | W和Z形成的物质中只含离子键 | |
| D. | 由Y形成的氢化物中可能是H2Y或YH3、YH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
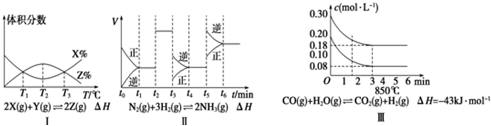
| A. | 由图I知,反应在T1、T3处达到平衡,且该反应的△H<0 | |
| B. | 由图II知,反应在t1时,NH3体积分数最大 | |
| C. | 由图II知,t3时采取的措施是降低反应体系温度 | |
| D. | III在10 L容器、850℃时反应,由图知,到4 min时,反应放出5.16 kJ的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com