
【题目】海水中含有氯化镁,是镁的重要来源之一。从海水中制取镁,可按如下步骤进行:
①把贝壳制成石灰乳 (主要成份是氢氧化钙) ②在引入的海水中加石灰乳,沉降、过滤、洗涤沉淀物 ③将沉淀物与盐酸反应,结晶、过滤、干燥产物 ④将得到的产物熔融后电解。关于从海水中提取镁,下列说法不正确的是
A. 此法的优点之一是原料来源丰富
B. 以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应
C. 第④步电解制镁是由于镁是很活泼的金属
D. 进行①②③步骤的目的是从海水中提取氯化镁
【答案】B
【解析】A.海水中主要含有Na+、K+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO-3等离子,所以从海水中提取镁,原料来源丰富,故A正确;B.海水中的镁离子和氢氧化钙反应,为复分解反应,得到氢氧化镁的沉淀,制取盐酸为化合反应,氢氧化镁和盐酸反应得到氯化镁,为复分解反应,氯化镁电解为分解反应,该过程中未涉及的反应为置换反应,故B错误;C.第④步电解熔融氧化镁,产物为镁和氯气,MgCl2(熔融)![]() Mg+Cl2↑,故C正确;D.从海水中提取金属镁,最基本的方法是往海水里加石灰乳,得到Mg(OH)2沉淀,将沉淀分离后再加入盐酸变成MgCl2;之后经过滤、干燥、电解,即可得到金属镁,据此结合从海水中提取镁的步骤知:①②③步骤的目的是从海水中获取MgCl2,故D正确;故选B。
Mg+Cl2↑,故C正确;D.从海水中提取金属镁,最基本的方法是往海水里加石灰乳,得到Mg(OH)2沉淀,将沉淀分离后再加入盐酸变成MgCl2;之后经过滤、干燥、电解,即可得到金属镁,据此结合从海水中提取镁的步骤知:①②③步骤的目的是从海水中获取MgCl2,故D正确;故选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )
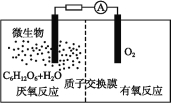
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下面列出了几组物质,请用序号填空。
①金刚石与“足球烯” C 60 ;② D 与 T ;③氧气与臭氧;④CH4 和 CH3CH2 CH3 ;⑤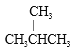 和CH3CH2CH2CH2CH3;⑥
和CH3CH2CH2CH2CH3;⑥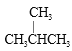 和和 CH3CH2CH2CH3
和和 CH3CH2CH2CH3
属于同位素的是________________,属于同系物的是_______________,属于同素异形体的是____________,属于同 分异构体的是______________。
(2)已知一定条件下,金刚石转化为石墨释放出能量,则等质量的金刚石比石墨具有的能量__________(填“高”、“低”),故金刚石比石墨稳定性______(填“强”、“弱”),等质量的金刚石和石墨充分燃烧均生成二 氧化碳,____________放出热量多。
(3)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
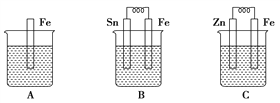
①B 中 Sn 极的电极反应式为____________________,
Sn 极附近溶液的 pH___________________。
②C 中总反应离子方程式为_________________。 比较 A、B、C 中铁被腐蚀的速率,由快到慢的顺 序是___________。
(4)如图是甲烷燃料电池原理示意图,回答下列问题:
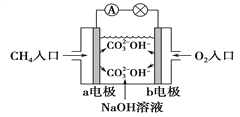
①电池的负极是____________(填“a”或“b”)电极, 该极的电极反应是_______________________。
② 电池工作一段时间后电解质溶液的 pH______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普及化学知识有助于人们树立健康的观念。下列观念正确的是
A. 天然物质都是绿色无毒的物质 B. 只饮用纯净水有益人体健康
C. 微量元素只能通过保健品摄入 D. 禁止吸烟可减少室内空气污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某黑色粉末由两种物质组成,为鉴定其成分进行如下实验:
①取少量样品加入足量冷的稀硫酸,有气泡产生,固体部分溶解
②另取少量样品加入足量浓盐酸并加热,有气泡产生,固体全部溶解
该黑色粉末可能为( )
A.Fe、MnO2
B.C,FeS
C.Si、FeO
D.CuO,Ag2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素在化学反应中,由化合态变为游离态,则该元素( )
A.化合价降低为零 B.化合价一定降低
C.可能化合价降低,也可能化合价升高 D.化合价一定升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠又名“大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂。硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图1所示。
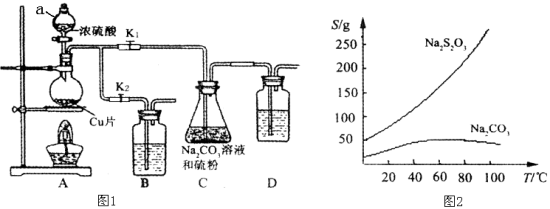
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图2所示,
(1)Na2S2O3·5H2O的制备:
步骤1:如图连接好装置后(未装药品),检查A、C装置气密性的操作是 。
步骤2:加入药品,打开K1、关闭K2,加热。装置B、D中的药品可选用下列物质中的 (填编号)。
A.NaOH溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.饱和NaHCO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液 、过滤、洗涤、烘干,得到产品。
(2)Na2S2O3性质的检验:向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的化学方程式 。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解。此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18. 00 mL。部分反应的离子方程式为:Cr2O72- + 6 I- + 14H+ = 2 Cr3+ + 3 I2 + 7 H2O;I2 + 2 S2O32- = S4O62-+2I-。则该废水中Ba2+的物质的量浓度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com