
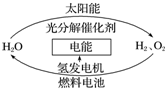
 为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法正确的是( )
为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法正确的是( )| A. | 氢能源已被普遍使用 | |
| B. | H2O的分解反应是吸热反应 | |
| C. | 氢气不易贮存和运输,无开发利用价值 | |
| D. | 2 mol 液态H2O具有的总能量高于2 mol H2和1 mol O2的能量 |
分析 A.氢能源将成为21世纪的主要绿色能源,氢气是通过电解制备的,耗费大量电能,廉价制氢技术采用太阳能分解水,但技术不成熟,是制约氢气大量生产的因素,氢能源未被普遍使用;
B.H2O的分解反应是吸热反应;
C.由于氢气难压缩,且易燃烧,所以对氢气的运输和安全问题目前未解决,氢气燃烧产物是水,不污染环境;氢气的燃烧值高;
D.因为H2O的分解反应是吸热反应,所以2molH2O具有的总能量低于2molH2和1molO2的能量.
解答 解:A.氢能源将成为21世纪的主要绿色能源,氢气是通过电解制备的,耗费大量电能,廉价制氢技术采用太阳能分解水,但技术不成熟,是制约氢气大量生产的因素,氢能源未被普遍使用,故A错误;
B.H2O的分解反应是吸热反应,故B正确;
C.由于氢气难压缩,且易燃烧,所以对氢气的运输和安全问题目前未解决,氢气燃烧产物是水,不污染环境;氢气的燃烧值高,所以氢能开发利用价值,故C错误;
D.因为H2O的分解反应是吸热反应,所以2molH2O具有的总能量低于2molH2和1molO2的能量,故D错误;
故选B.
点评 本题考查了氢能源的优点,但氢能源也有缺点,如:氢气制备成本高、不易保存、安全性低等,同学们需要全面的分析问题,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | Mg(OH)2不溶于水,但能溶于浓NH4Cl溶液中 | |
| B. | 水垢中含有的CaSO4,先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,再用酸除去 | |
| C. | 洗涤BaSO4沉淀时,用稀硫酸洗涤BaSO4沉淀比用蒸馏水洗涤损失少 | |
| D. | FeCl3溶液中混有FeCl2,常加入少量的H2O2,使Fe2+氧化为Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
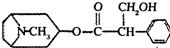
 或
或 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
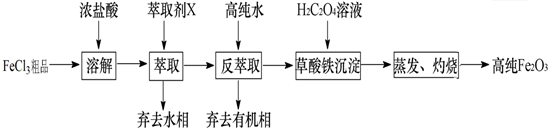
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
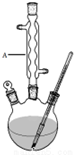 冬青油又叫水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(
冬青油又叫水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(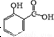 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熵增加且放热的反应一定是自发反应 | |
| B. | X?Y+Z正反应吸热,则逆反应必然放热 | |
| C. | 化学反应的焓变△H越大,表示放热越多 | |
| D. | 稀溶液中,酸碱中和反应生成1 mol H2O时放热不一定为57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
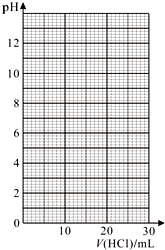 化学兴趣小组的同学用0.100 0 mol/L 盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
化学兴趣小组的同学用0.100 0 mol/L 盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:| V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 |
| pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 |
| V(HCl)/mL | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 | |
| pH | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的NaOH溶液与0.1 mol/L的CH3COOH溶液等体积混合c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| B. | 常温下,0.01 mol/L的NaOH溶液与pH=2的CH3COOH溶液等体积混合c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 常温下,0.1 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液混合后使pH=7,c(CH3COO-)=c(Na+)>c(H+)=c(OH-) | |
| D. | 0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应放热是因为反应物的总能量低于生成物的总能量 | |
| B. | 不需要加热就能发生的反应是放热反应 | |
| C. | 化学能是能量的一种形式,它不仅可以转化为热能,也能转化为电能 | |
| D. | 氯化钠晶体熔化时,离子键被破坏,吸收能量,发生化学变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com