
| A. | 标准状况下,22.4 L乙烯含有的共用电子对数为5NA | |
| B. | lmolNaHSO4中的阳离子数为2NA | |
| C. | 通常状况下,lmolNO和0.5molO2在密闭容器中混合,生成NO2分子数为NA | |
| D. | 制取漂白粉时,标准状况下22.4LC12参加反应,转移电子数为NA |
分析 A.据乙烯中含6对共用电子,根据n=$\frac{V}{Vm}$计算出乙烯的物质的量,然后计算出含有共用电子对的物质的量及数目;
B.硫酸氢钠是由钠离子与硫酸氢根离子通过离子键结合而成,阳离子为钠离子;
C.NO2和N2O4之间存在转化,方程式2NO2?N2O4;
D.求出氯气的物质的量,然后根据氯气和碱反应是歧化反应来分析.
解答 解:A..标况下22.4L乙烯的物质的量为1mol,而乙烯中含6对共用电子对,故1mol乙烯中含6NA个共用电子对,故A错误;
B.硫酸氢钠阳离子为钠离子,1molNaHSO4中的钠离子为1mol,个数NA,故B错误;
C.NO和O2反应方程式为2NO+O2=2NO2,根据方程式知,1molNO与0.5molO2恰好完全反应生成1molNO2,但NO2和N2O4之间存在转化,方程式2NO2?N2O4,所以产物分子数小于NA,故C错误;
D.标况下22.4L氯气的物质的量为1mol,而氯气和碱反应是歧化反应,1mol氯气转移NA个电子,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数的有关计算和判断,熟悉物质的结构,明确二氧化氮与四氧化二氮之间转化是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 生铁比软铁芯(几乎是纯铁)容易生锈 | |
| B. | 银质奖牌久置后表面变暗 | |
| C. | 铁质器件附有铜质配件,在接触处易生铁锈 | |
| D. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质编号 | 物质转化关系 | a | b | c | d |
| ① | 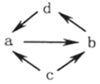 | NO | NO2 | N2 | HNO3 |
| ② | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
| ③ | SiO2 | Na2SiO3 | Si | H2SiO3 | |
| ④ | SO2 | SO3 | S | H2SO4 |
| A. | ①② | B. | ②③ | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用AgNO3溶液可以鉴别KCl和KI | |
| B. | 制备乙酸乙酯时可用饱和Na2CO3溶液收集产物以除去其中的乙酸 | |
| C. | 制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体 | |
| D. | SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- | |
| B. | 新制氯水中:Cl2+H2O?2H++ClO-+Cl- | |
| C. | 200 mL 2 mol/L的FeBr2溶液中通入11.2L标准状况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- | |
| D. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键所致 | |
| B. | 乳酸[CH3CH(OH)COOH]有一对对映异构体,因为其分子中含有一个手性碳原子 | |
| C. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| D. | SiCl4的分子中硅氯键的极性比CCl4中的碳氯键强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com