间接碘量法测定胆矾中铜含量的原理和方法如下:
已知:在弱酸性条件下,胆矾中Cu2+与 I-作用定量析出 I2;I2溶于过量的KI溶液中:I2+I-═I3-;且在溶液中:Fe3++6F-=[FeF6]3-( 六氟合铁(III)络离子 )
又知:微粒的氧化性强弱顺序为:Fe3+>Cu2+>I2>FeF63-
析出I2可用cmol/LNa2S2O3标准溶液滴定:2S2O32-+I3-═S4O62-+3I-.
现准确称取ag胆矾试样,置于250mL碘量瓶(带磨口塞的锥形瓶)中,加50mL蒸馏水、5mL3mol/LH2SO4溶液,加少量NaF,再加入足量的10%KI溶液,摇匀.盖上碘量瓶瓶盖,置于暗处5min,充分反应后,加入1~2mL0.5%的淀粉溶液,用Na2S2O3标准溶液滴定到蓝色褪去时,共用去VmL标准液.
(1)实验中,在加KI前需加入少量NaF,推测其作用可能是______;
(2)实验中加入稀硫酸,你认为硫酸的作用是______;
(3)本实验中用碘量瓶而不用普通锥形瓶是因为______;
(4)硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,该反应的离子方程式为:______;
(5)根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)=______%.
解:(1)胆矾加酸溶解后溶液中含有Fe
3+,Fe
3+能氧化I
-生成I
2,造成Cu的质量偏大,影响测定结果,加入少量NaF,发生反应Fe
3++6F-=[FeF
6]
3-,FeF
63-不能氧化I
-,
故答案为:掩蔽Fe
3+,防止造成偏大的误差;
(2)Cu
2+能发生水解反应溶液呈酸性,提供酸性条件,抑制Cu
2+的水解,故答案为:提供酸性条件,抑制Cu
2+的水解;
(3)用碘量瓶溶液不与空气中氧气接触,而用普通锥形瓶能与空气中氧气接触,氧气能与碘化钾反应生成单质碘,所以用碘量瓶防止空气中的氧气与碘化钾反应,
故答案为:防止空气中的氧气与碘化钾反应;
(4)硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,离子方程式为:2Cu
2++4I
-=2CuI↓+I
2,故答案为:2Cu
2++4I
-=2CuI↓+I
2;
(5)Na
2S
2O
3标准溶液的物质的量为cmol/L×V×10
-3L,由关系式:2Cu
2+~I
2~I
3-~2S
2O
32-,可知:Cu
2+的物质的量为cmol/L×V×10
-3L,
Cu
2+的质量为:cmol/L×V×10
-3L×64g/mol,所以ω(Cu)=
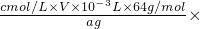
100%=
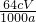
×100%,
故答案为:
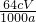
×100%.
分析:(1)根据胆矾加酸溶解后溶液中含有Fe
3+,Fe
3+能氧化I
-生成I
2来分析;
(2)根据Cu
2+能发生水解反应溶液呈酸性来分析;
(3)根据碘量瓶溶液不与空气中氧气接触,而用普通锥形瓶能与空气中氧气接触,氧气能与碘化钾反应生成单质碘;
(4)根据关系式:2Cu
2+~I
2~I
3-~2S
2O
32-,先计算出Cu
2+的物质的量和质量,再用Cu
2+的质量除以样品质量即可.
点评:本题主要考查了化学实验与计算,涉及的知识点较多,第(1)问的难度较大,通过审题要得出溶液中含有Fe
3+即可完成.

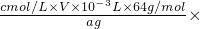 100%=
100%=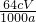 ×100%,
×100%,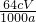 ×100%.
×100%.

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案