
【题目】下列实验结论与实验操作及现象相符的一组是( )
选项 | 实验操作及现象 | 实验结论 |
A. | 向某溶液中加入HCl 溶液,产生的气体使澄清的石灰水变浑浊 | 该溶液中含有CO32- |
B. | 向某溶液中通入Cl2,再加入KSCN溶液,溶液变红 | 该溶液中一定含有Fe2+ |
C. | 铁粉加入CuSO4溶液中,析出红色固体 | 氧化性:Fe2+ > Cu2+ |
D. | 向FeCl3溶液中滴加浓的维生素C溶液,黄色褪去 | 维生素C具有还原性 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
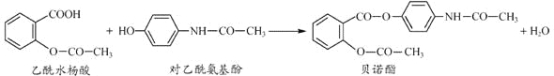
下列有关叙述正确的是( )
A. 贝诺酯分子中有三种含氧官能团
B. 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚
C. 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应
D. 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、硒形成的单质及其化合物有重要的科学研究价值,请回答下列问题:
(1)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。基态氮原子的价电子轨道表示式为______________;其核外电子共占据____个能级;邻氨基吡啶的铜配合物中Cu2+的配位数是_______。

(2)高聚氮晶体结构如图所示,每个氮原子与另外三个氮原子结合形成空间网状结构。固态高聚氮是_______晶体;该晶体中n(N)与n(N—N)之比为_______;这种高聚氮N—N键的键能为160 kJ·mol-1,而N2的键能为942 kJ·mol-1,其可能潜在的应用是__________。

(3)NO3-的空间构型是________;HNO3的酸性比HNO2强,试从结构的角度解释其原因__________。
(4)硒有三种晶体(α单斜体、β单斜体和灰色三角晶),灰硒的晶体为六方晶胞结构,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶胞结构图和晶胞俯视图如图所示:

已知正六棱柱的边长为acm,高为bcm,阿伏加德罗常数的值为NA,则该晶体的密度为_____g·cm-3(用含NA、a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.0.1mol Fe与足量氯气反应时,转移的电子数目为0.2NA
B.常温常压下,18 g H2O中含有的原子总数为3NA
C.标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA
D.1 L 0.1 mol·L-1硫酸钠溶液中含有的氧原子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁易生锈是因为在潮湿的空气里,其表面吸附一层薄薄的水膜,构成了若干微小原电池(如图所示)。下列有关说法正确的是 ( )

A.负极的电极反应式为Fe-3e-=Fe3+
B.钢铁生锈过程中电能转化为化学能
C.O2在正极参加反应生成OH-
D.为减缓铁制品生锈,可将其与铜相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解锰工艺过程会产生锰、镁复盐,其组成为(NH4)7MnMg2(SO4)6.521H2O。一种综合利用该复盐的工艺流程如图所示:
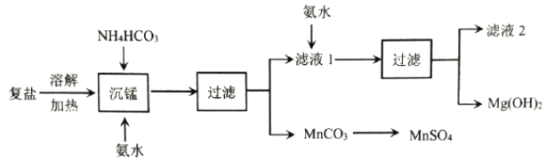
已知:Ksp[Mg(OH)2]=1.8×10-11,Kb(NH3H2O)=1.8×10-5。回答下列问题:
(1)(NH4)7MnMg2(SO4)6.521H2O的水溶液呈__________________性(填“酸”或“碱”) ,Mn的化合价为__________________。
(2)“沉锰”的离子反应方程式为__________________;滤液1溶质的主要成分有__________________。
(3)“沉锰”过程中pH和温度对Mn2+和Mg2+沉淀率的影响如图所示:
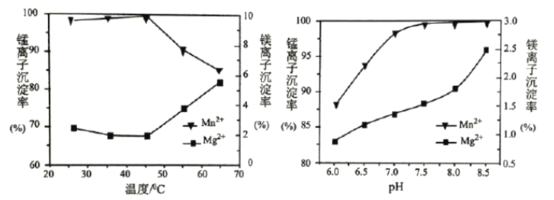
①由图可知,“沉锰”合适的条件为__________________。
②Mg2+主要生成的是__________________沉淀(填“Mg(OH)2”或“MgCO3”),当温度高于45℃时Mg2+和Mn2+沉淀率的变化如图所示,原因是__________________。
(4)若将NH3通入0.01molL-1MgSO4溶液至Mg2+完全沉淀,则此时溶液中NH3H2O的物质的量浓度为__________________。(已知![]() =1.34,忽略反应前后溶液体积的变化,计算结果保留两位有效数字)
=1.34,忽略反应前后溶液体积的变化,计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)在微生物作用的条件下,NH4+经过两步反应被氧化成 NO3-。两步反应的能量变化示意图如下:

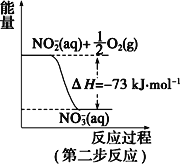
(1)第一步反应是_________(填“放热”或“吸热”)反应。
(2)1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是___________。
(二)用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
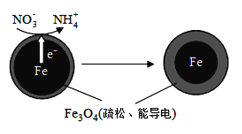
①作负极的物质化学式为___________。
②正极的电极反应式是_______________。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是_______________。
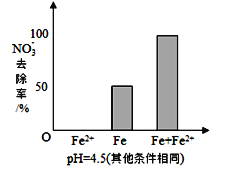
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_________。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4,该反应的离子方程式为_________解释加入Fe2+提高NO3-去除率的原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类应用较早,当前应用量最大的金属元素。下列有关说法中正确的是( )
A.人类使用铁制品在铝之后
B.常温下,铁不能与浓硝酸反应
C.铁与水蒸气在高温下的反应产物为Fe2O3和H2
D.除去FeCl3溶液中的FeCl2杂质可以向溶液中加入适量氯水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】邻苯二甲酸(用H2A表示)为二元弱酸,常温下,Ka1=1.1×10-3,Ka2=3.9×10-6,室温下用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 H2A溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是
A.滴加20 mL NaOH溶液时:c(OH-)>c(H+)+c(H2A )-2c(A2-)
B.pH=7的溶液:c(Na+)<0.050 00 mol·L-1+c(A2-) -c(H2A)
C.滴定过程中可能会出现:c(Na+)>c(HA-)=c(A2-)>c(OH-)>c(H+)
D.滴加40 mL NaOH溶液时:2c(Na+)=c(H2A)+c(A2-)+c(HA-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com