
已知用MnO2与浓盐酸反应制Cl2时,当溶液中盐酸浓度降为4mol·L-1时即不再有Cl2产生。常用浓盐酸浓度为12mol·L-1。实验中用MnO2与浓盐酸反应制Cl2时,消耗浓盐酸的体积(ml)与MnO2质量关系如图所示。试根据上述信息分析回答:

(1)用8.7gMnO2与100mL浓盐酸反应可产生Cl2多少mL(标准状况)?
某同学最终只收集到2000mLCl2(标准状况),若装置的气密性没有问题,则可能的原因是
。
(2)由题中信息计算将8. 7gMnO2完全消耗,需浓盐酸的体积为多少?
(3)而实际实验中消耗盐酸的体积为 mL,可能原因是:
【解析】
试题分析:(1)n(MnO2)=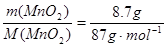 =0.1mol
=0.1mol
能参加反应的n(HCl)=Δc(HCl)·V〔HCl(aq)〕
=(12mol/L-4mol/L)×0.1L
=0.8mol
由反应MnO2+4HCl=MnCl2+ Cl2↑ +2H2O
1mol 4mol 1mol
可知MnO2完全反应
所以V(Cl2)=n(Cl2)·Vm
=0.1mol×22400ml/mol
=2240ml
由于容器内有残留一部分氯气没有排出来,以及收集氯气时有部分氯气逸散,所以导致收集到的氯气偏少。
(2)8.7g二氧化锰完全消耗,需要氯化氢的物质的量是0.4mol
所以V〔HCl(aq)〕=
=0.05L=50ml
(3)根据图像可知实际消耗的盐酸体积是60ml。这是由于随着反应的进行,加热时浓盐酸挥发造成损失引起的。
考点:考查化学反应中的过量计算
点评:本题是基础性试题的考查,试题难易适中,注重基础和能力的双向考查,有利于调动学生的学习兴趣,更有利于培养学生的逻辑思维能力。


科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058
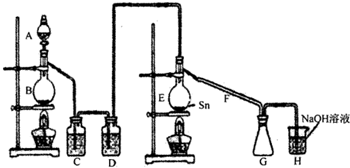
(1)装置A中的反应原理可以认为是MnO2将浓H2SO4与食盐反应产生的HCl氧化成Cl2,产生的两种盐是NaHSO4、MnSO4。装置A中反应的化学方程式______________________
________________________________。
(2)为使实验成功,A和B间需要加适当的装置,请将它画在框内,并注明其中盛放的药品。
(3)进行实验时,应先点燃(填写字母,下同)________处的酒精灯,当反应生成SnCl4时,应熄火________处的酒精灯,理由是________________________。
(4)装置C的作用是________________________________。
(5)进行此实验,D装置后应当连接的装置及作用是(按从左到右的顺序写出仪器名称及其中的药品)___________________________________________________________________
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:058
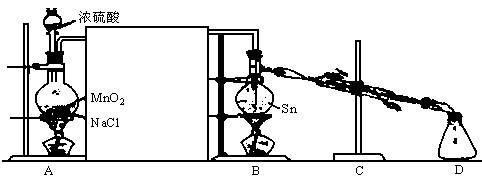
实验室用干燥、纯净的Cl2与熔融的Sn反应制SnCl4:Sn+2Cl2![]() SnCl4同时放大量的热,已知SnCl4常温下是无色液体,沸点:114℃,遇潮湿空气便发生水解反应(SnCl4+2H2O══SnO2+4HCl)产生白色烟雾。Sn的熔点:231℃,下图是制取SnCl4的实验装置。试回答以下问题:
SnCl4同时放大量的热,已知SnCl4常温下是无色液体,沸点:114℃,遇潮湿空气便发生水解反应(SnCl4+2H2O══SnO2+4HCl)产生白色烟雾。Sn的熔点:231℃,下图是制取SnCl4的实验装置。试回答以下问题:

(1)装置A中的反应原理可以认为是MnO2将浓H2SO4与食盐反应产生的HCl氧化成Cl2,产生的两种盐是NaHSO4、MnSO4。装置A中反应的化学方程式______________________
________________________________。
(2)为使实验成功,A和B间需要加适当的装置,请将它画在框内,并注明其中盛放的药品。
(3)进行实验时,应先点燃(填写字母,下同)________处的酒精灯,当反应生成SnCl4时,应熄火________处的酒精灯,理由是________________________。
(4)装置C的作用是________________________________。
(5)进行此实验,D装置后应当连接的装置及作用是(按从左到右的顺序写出仪器名称及其中的药品)___________________________________________________________________
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年天津市五区县高三质量检查试卷(一)理综化学试卷(解析版) 题型:实验题
SO2是一种重要的化工原料,也是引起酸雨污染的重要来源。
(1)某兴趣小组采用如图所示装置制取SO2

①下列实验方案适用如图所示装置制取所需SO2的试剂是_______(填序号)。
A.Na2SO3溶液与稀硝酸
B.Na2SO3固体与浓硫酸
C.固体硫和氧气
D.铜与浓硫酸
②a的仪器名称是_______。
③尾气吸收装置的连接顺序是b接( )接 ( )接e。
(2)为了回收利用SO2废气,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体( 生产流程,其流程示意图如下:
生产流程,其流程示意图如下:
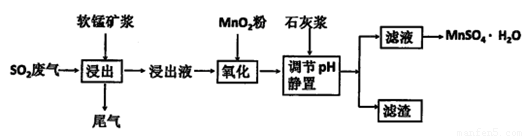
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时溶液的pH见下表:

请回答:
①含Al3+的盐常用作净水剂,用离子方程式表示其净水原理________________________。
②浸出过程中主要反应的化学方程式是___________________________________________。
③氧化过程中加入MnO2粉的目的是______________________________________________;
反应的离子方程式是_________________________________________________________。
④用石灰浆调节pH,pH应调节的范围是___________________________________。
⑤滤渣的主要成分是____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com