
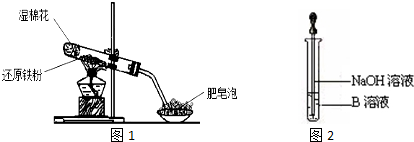
分析 (1)硬质试管中中铁与水蒸气反应会生成四氧化三铁和氢气,固体成分为四氧化三铁,可能含有铁;
(2)硬质试管中中铁与水蒸气反应会生成四氧化三铁和氢气分析判断;
(3)KSCN溶液溶液变红色,说明有三价铁离子;溶液未变红色,说明无三价铁离子;
(4)铁单质能将三价铁离子还原成二价铁离子;
(5)滴入NaOH溶液时,生成的白色沉淀迅速变成灰绿色,最后变成红褐色;
(6)铁单质能将三价铁离子还原成二价铁离子,Fe2+具有还原性,Fe2+易被空气中的氧气氧化而变质,Fe2+溶液易水解.
解答 解:(1)硬质试管中固体的成分中:一定含有Fe3O4,可能含有Fe,
故答案为:Fe3O4,Fe;
(2)铁与水蒸气反应会生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(3)KSCN溶液溶液变红色,说明有三价铁离子,说明硬质试管中固体一定有Fe3O4,可能有Fe;KSCN溶液未变红色,说明无三价铁离子,一定有Fe3O4和Fe,
故答案为:Fe3O4和Fe;
(4)铁单质能将三价铁离子还原成三价铁离子离子方程式,Fe+2Fe3+=3Fe2+,故答案为:Fe+2Fe3+=3Fe2+;
(5)滴入NaOH溶液时,生成的白色沉淀迅速变成灰绿色,最后变成红褐色,该反应为FeSO4+2NaOH=Fe(OH)2↓+Na2SO4;4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(6)铁单质能将三价铁离子还原成二价铁离子,Fe2+具有还原性,Fe2+易被空气中的氧气氧化而变质,Fe2+溶液因为水解和还原性而不易保存,可以加入酸抑制其水解,加入还原性铁(铁钉)防止其被氧化,
故答案为:还原;Fe2+ 易被空气中的氧气氧化而变质;铁粉.
点评 本题考查铁及其化合物的性质实验,题目难度中等,注意三价铁离子与二价铁离子的转化、Fe3+和Fe2+ 的检验、Fe2+ 的还原性以及Fe(OH)3的制备,综合性较强,但难度适中,是一道非常典型的题目.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L HR溶液与0.1mol/L氨水等体积反应,所得溶液呈酸性 | |
| B. | NaR晶体用蒸馏水配成水溶液,PH试纸测得PH大于7 | |
| C. | 将PH=2.3的HR溶液加蒸馏水稀释10倍,PH变成2.8 | |
| D. | 常温下,0.1mol/L HR溶液的pH为2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
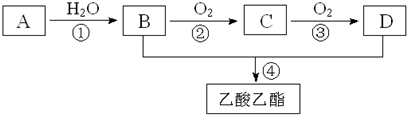
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

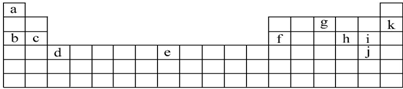
| A. | a、b、c的简单离子中,a的离子半径最大 | |
| B. | c、d、f最高价氧化物对应的水化物两两之间均可发生反应 | |
| C. | e的氢化物比f的氢化物的稳定性高 | |
| D. | a、e可形成一种新型无机非金属材料--高温结构陶瓷 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,32 g O2含有氧原子数为NA | |
| B. | 标准状况下,22.4 L H2O含有的分子数为NA | |
| C. | 18g H2O中含有的电子数为10NA | |
| D. | 0.5mol•L-1CaCl2溶液中含Cl-数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维、棉花、油脂、ABS树脂都是由高分子化合物组成的物质 | |
| B. | 红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 | |
| C. | 开发核能、太阳能等新能源,推广基础甲醇汽油,使用无磷洗涤剂都可直接降低碳排放 | |
| D. | 阴极射线、α粒子散射现象及布朗运动的发现都对原子结构模型的建立作出了贡献 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com