
【题目】麻黄素是中枢神经兴奋剂,其合成路线如图所示。NBS是一种选择性溴代试剂。
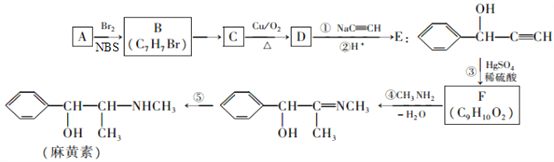
已知:①A的分子量为92
②
(1)其中A为烃,则A的分子式是__________
(2)写出B![]() C的化学方程式_______
C的化学方程式_______
(3)实验室检验D中官能团的方法为________。
(4)反应①的反应类型是______,F的结构简式是__________。
(5)有机物N与F互为同分异构体,满足下列条件的有机物N的结构有_____种;
①苯环上只有一个取代基 ②能发生水解反应 ③含有甲基
(6)参照上述合成路线信息,设计一条以乙醇为原料选用必要的试剂合成CH3CHOHCOCH3的流程。_____________
【答案】 C7H8 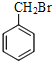 +NaOH
+NaOH![]()
 +NaBr 取物质D的样品少量于试管中,加入银氨溶液,水浴加热后若有光亮的银镜出现说明D中含有醛基。(或加入新制取的氢氧化铜的碱性悬浊液加热后出现红色沉淀) 加成反应
+NaBr 取物质D的样品少量于试管中,加入银氨溶液,水浴加热后若有光亮的银镜出现说明D中含有醛基。(或加入新制取的氢氧化铜的碱性悬浊液加热后出现红色沉淀) 加成反应 ![]() 5 CH3CH2OH
5 CH3CH2OH![]() CH3CHO
CH3CHO![]()
![]()
![]()
【解析】试题分析:本题考查有机推断和有机合成,侧重考查有机物分子式的确定、官能团的识别、有机物结构简式和方程式的书写、官能团的检验、限定条件同分异构体数目的确定、有机合成路线的设计。
(1)A为烃,A的相对分子质量为92,用“商余法”,92![]() 12=7……8,A的分子为C7H8。
12=7……8,A的分子为C7H8。
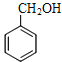
(2)根据流程对比A和B的分子式,A→B为取代反应;C与Cu/O2、加热转化为D,C→D为醇的催化氧化,C中含醇羟基,D中含醛基;D与①NaC![]() CH、②H+作用后得到E,根据E的结构简式可逆推出D的结构简式为
CH、②H+作用后得到E,根据E的结构简式可逆推出D的结构简式为![]() ,C的结构简式为
,C的结构简式为 ,B的结构简式为
,B的结构简式为 ,A的结构简式为
,A的结构简式为![]() 。B→C的化学方程式为
。B→C的化学方程式为 +NaOH
+NaOH![]()
 +NaBr。
+NaBr。
(3)D的结构简式为![]() ,D中的官能团为-CHO,检验-CHO可用银氨溶液或新制Cu(OH)2悬浊液,检验D中官能团的方法:取物质D的样品少量于试管中,加入银氨溶液,水浴加热后若有光亮的银镜出现说明D中含有醛基。(或加入新制取的Cu(OH)2的碱性悬浊液加热后若出现红色沉淀说明D中含有醛基)
,D中的官能团为-CHO,检验-CHO可用银氨溶液或新制Cu(OH)2悬浊液,检验D中官能团的方法:取物质D的样品少量于试管中,加入银氨溶液,水浴加热后若有光亮的银镜出现说明D中含有醛基。(或加入新制取的Cu(OH)2的碱性悬浊液加热后若出现红色沉淀说明D中含有醛基)
(4)根据D和E的结构简式,以及D→E的反应试剂,反应①的反应类型为加成反应。根据E→F的反应条件,E→F发生题给已知②的反应,结合F的分子式(C9H10O2),F的结构简式为![]() 。
。
(5)F的不饱和度为5,F的同分异构体N能发生水解反应,N中含酯基,N的苯环上只有一个取代基且含有甲基;符合条件的N的结构简式为:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,符合条件的N的结构有5种。
,符合条件的N的结构有5种。
(6)CH3CHOHCOCH3与F中含有相同的官能团,对比CH3CH2OH和CH3CHOHCOCH3的结构简式,本题的合成路线应仿流程中C→D→E→F,CH3CH2OH先发生催化氧化反应生成CH3CHO,CH3CHO与①NaC![]() CH、②H+作用得到
CH、②H+作用得到![]() ,
,![]() 在HgSO4、稀硫酸存在下生成CH3CHOHCOCH3,合成路线为:CH3CH2OH
在HgSO4、稀硫酸存在下生成CH3CHOHCOCH3,合成路线为:CH3CH2OH![]() CH3CHO
CH3CHO![]()
![]()
![]()
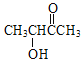 。
。


科目:高中化学 来源: 题型:
【题目】有一包白色粉末,由BaCl2、K2SO4、CaCO3、NaOH、CuSO4中的一种或几种组成,为了探究它的成份,进行了如下实验:下列判断正确的是
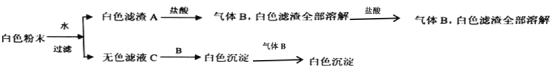
A. K2SO4、CuSO4一定不存在
B. BaCl2一定不存在
C. K2SO4、CaCO3、BaCl2一定存在
D. 滤液C中只含有BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铂(Pt)可以和很多化合物形成配合物,生产生活中有重要的用途。
(1)铂和氨水可以形成配合物。可用于提取铂。氨水中各元素的第一电离能由大到小的顺序___。
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体,科学研究表明,反式分子和顺式分子一样具有抗癌活性。
①C1-的核外电子排布式为_______。
②吡啶分子是大体积平面配体,其结构简式为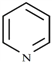 ,吡啶分子中氮原子的轨道杂化方式是_____,分子中的大π键可用符号
,吡啶分子中氮原子的轨道杂化方式是_____,分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π鍵的电子数,则吡啶中的大π键应表示为_____;1mol吡啶中含有σ键的数目为________
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π鍵的电子数,则吡啶中的大π键应表示为_____;1mol吡啶中含有σ键的数目为________
③二氯二吡啶合铂分子中存在的微粒间作用力有_____(填字母)。
a.离子健 b.配位键c.金属键 d.非极性键e.氢键f.极性键
④二氯二吡啶合铂分子中,Pt2+的配位数是4,但是其轨道杂化方式并不是sp3。简述理由_____________。
⑤反式二氯二吡啶合铂分子结构如图所示,该分子是_____分子(其“极性”或“非极性”)。
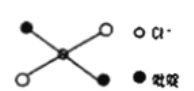
(3)富勒烯C60能够与Pt结合形成一系列络合物。富勒烯(C60)的结构如图所示,C60属于____晶体;C60分子中五元环与六元环的数目比为__________。
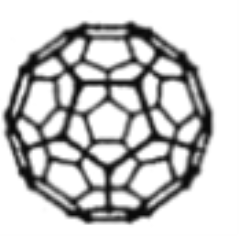
(已知简单多面体的顶点数V、棱数E及面数F间有如下关系:V-E+F=2)。
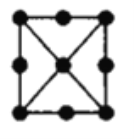
(4)金属铂立方晶胞的二维投影图如图所示。若金属铂的密度dg/cm3,则晶胞参数a=___nm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制100mL1.0mol·L-1的NaOH溶液,下列情况不会影响溶液浓度的是
A. 容量瓶使用前有蒸馏水
B. 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C. 俯视确定凹液面与刻度线相切
D. 称量NaOH固体时使用了称量纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在有机合成、能源开发等工农业方面具有十分广泛的应用。
I.工业生产精细化工产品乙二醛(OHC-CHO)
(1)乙醇(CH3CH2OH)液相硝酸氧化法:在Cu(NO3)2催化下,用稀硝酸氧化乙醇制取乙二醛,此反应的化学方程式为_______________。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点____________。
(2)乙二醇(HOCH2CH2OH)气相氧化法
已知:2H2(g)+O2(g) ![]() 2H2O(g)ΔH=-484kJ/mol,化学平衡常数为K1
2H2O(g)ΔH=-484kJ/mol,化学平衡常数为K1
OHC-CHO(g)+2H2(g) ![]() HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g) ![]() OHC-CHO(g)+2H2O(g)的ΔH=______;相同温度下,该反应的化学平衡常数K=______(用含K1、K2的代数式表示)。
OHC-CHO(g)+2H2O(g)的ΔH=______;相同温度下,该反应的化学平衡常数K=______(用含K1、K2的代数式表示)。
Ⅱ.CO2的综合利用
(3)一定量的CO2与足量的碳在体积可变的恒压密闭容器中发生反应C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。
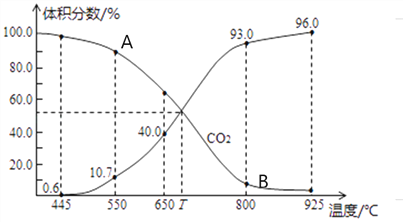
a.反应达平衡状态时,混合气体的平均相对分子质量保持不变
b.A点的正反应速率比B点正反应速率小
C.550℃时,若充入氦气,则V正、V逆均减小,平衡不移动
d.T℃时,反应达平衡后CO2的转化率为66.7%
e. T℃时,若再充入1molCO2和1molCO,平衡不移动
(4)氨气、CO2在一定条件下可合成尿素,其反应为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
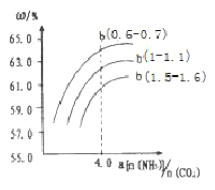
①b应控制在______
a.1.5-1.6b.1-1.1c.0.6-0.7
②a应控制在4.0的理由是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取0.1mol/L的NaA和NaB两种盐溶液各1L,分别通入0.02molCO2,发生如下反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3。HA和HB的1L溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正确的是
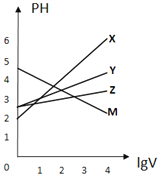
A. 相同条件下,对于c(R-)/[c(HR)·c(OH-)]的值(R代表A或B),一定存在HA>HB
B. 常温下pH:NaA溶液>NaB溶液
C. X是HA,M是HB
D. 若常温下浓度均为0.1mol/L的NaA和HA的溶液等体积混合,则c(A-)+c(HA)=0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由短周期元素组成的一些单质及其化合物之间的转化关系图。常温常压下,D、F、K均为无色无刺激性气味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体。(反应中生成的部分物质已略去)

请回答下列问题:
(1)物质A的化学式为________;
(2)化合物I的化学式为________;
(3)反应①的化学方程式为_____________;反应②的化学方程式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com