
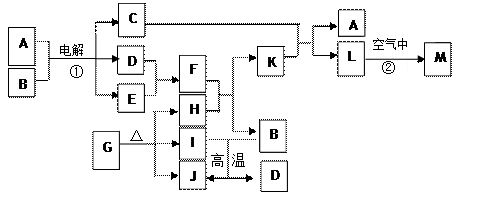
 ,M的化学式 ;
,M的化学式 ; 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.消耗硫酸亚铁铵的物质量为n(2-x)mol |
| B.处理废水中Cr2O72-的物质量为mol |
| C.反应中发生转移的电子数为3nx mol |
| D.在FeO·FeyCrxO3中3x=y |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
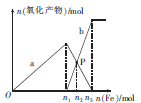
| A.a表示Fe3+的关系曲线 |
| B.n1=0.75 |
| C.P点时,n(Fe2+)="0.5625" mol |
| D.向P点溶液中加入铜粉,最多可溶解14.4 g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

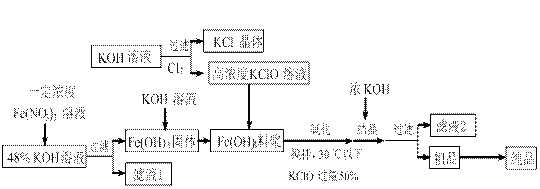
 ▲ 。
▲ 。 O3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为 ▲ 。
O3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为 ▲ 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CuSO4与Ca(OH)2含有葡萄生长所需的微量元素 |
| B.CuSO4与Ca(OH)2混合物是化学肥料 |
| C.Cu2+和碱可以使蛋白质变性,能杀死病菌,可以防治病虫害 |
| D.CuSO4与Ca(OH)2混合物是有机农药,可以防治病虫害 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Al(OH)4- + H+ ②NH3+H2O
Al(OH)4- + H+ ②NH3+H2O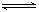 NH4+ + OH_
NH4+ + OH_查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com