
【题目】对于反应A(g)+3B(g)2C(g)+2D(g),其中反应速率最快的是( )
A.v(D)=0.30mol·L-1·s-1B.v(A)=0.50mol·L-1·s-1
C.v(B)=0.60mol·L-1·s-1D.v(C)=0.50mol·L-1·s-1
科目:高中化学 来源: 题型:
【题目】电子工业常用 30%的 FeCl3 溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)在加入①物质的过程中通常不断搅拌,搅拌的目的是_____。
(2)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的 FeCl3 溶液,准备采用下列步骤:

请写出上述实验中加入或生成的有关物质的化学式:①________,④____。
(3)要证明某溶液中不含 Fe3+而可能含有 Fe2+,进行如下实验操作时的最佳顺序为__________。
①加入足量氯水 ②加入足量KMnO4 溶液 ③加入少量KSCN 溶液
A.①③ B.③② C.③① D.①②③
(4)写出向②⑤的混合液中通入⑥的离子方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学根据下列仪器设计实验装置证明上述结论。请按要求回答问题。

(1)U形接管中所盛试剂的化学式为_______________。
(2)检验产物中HCl 的离子方程式:____________________。
(3)乙同学认为甲同学的实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加装置⑤。你认为装置⑤应加在________________之间(填装置序号)瓶中可以放入_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标号为①-⑩的元素,在元素周期表中的位置如下:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
试回答下列问题:
(1)②号元素是______![]() 填元素符号
填元素符号![]() ,⑨号元素的离子结构示意图为______
,⑨号元素的离子结构示意图为______
![]() 任写两种
任写两种![]() 。
。
(3)用电子式表示①④号元素形成的最简单化合物的形成过程______
(4)③的最高价氧化物与⑧的单质在点燃条件下发生反应的化学方程式______
(5)①、⑤、⑦号元素形成的化合物的电子式是______,该化合物所含化学键的类型为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究有机物A的组成与结构,某同学进行如下实验。
i.将9.0gA 在足量氧气中充分燃烧,并使其产物依次缓缓通过足量的浓硫酸和碱石灰,发现两者分别增重5.4g和13.2g。
ii.通过质谱法测得其相对分子质量为90。
ili.通过红外光谱法测得A中含有—OH和—COOH。
请回答下列问题。
(1)9.0gA完全燃烧生成水的物质的量是____________mol。
(2)A的实验式是____________。
(3)A的分子式是____________。
(4)在一定条件下,若两个A分子可以反应得到一个六元环的分子,则A的结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在调节好pH和Fe2+浓度的废水中加H2O2,能氧化降解污染物。现用该方法降解污染物p-CP,控制H2O2、Fe2+和p-CP的初始浓度相同,设计如下对比实验探究温度、pH对该降解反应速率的影响,测得p-CP的浓度随时间变化的关系如下图。
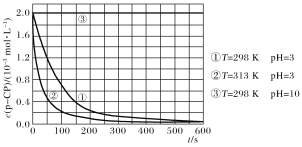
下列结论或推断不正确的是( )
A.实验①、②表明适当升高温度,降解反应速率增大
B.根据推断,在原来条件下适当升高温度和调高pH,p-CP的分解速率可能保持不变
C.313 K、pH=3时,在0~100 s内,p-CP的分解平均速率约为1.8×10-2mol·L-1·s-1
D.室温下调节溶液pH=10,可使催化剂失去活性, p-CP几乎不分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作不能达到目的的是( )
A.装置①验证温度对反应2NO2(g)N2O4(g)平衡移动的影响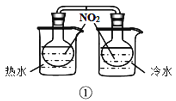
B.装置②验证增大反应物浓度对平衡的影响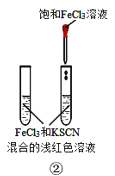
C.装置③测定中和热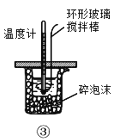
D.装置④比较Cu2+、Fe3+对H2O2分解速率的影响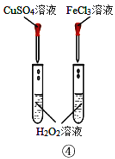
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、NO、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:CO可将部分氮的氧化物还原为N2。
反应Ⅰ:2CO(g)+2NO(g) N2(g)+2CO2(g) △H=-746kJ/mol
反应Ⅱ:4CO(g)+2NO2(g) N2(g)+4CO2(g) △H=-1200kJ/mol
则反应NO2(g) + CO(g) CO2(g) + NO(g)的△H=_____________kJ/mol。
(2)温度为T℃时,在一个容积为10L的恒容密闭容器中,充入1mol CO和0.5mol SO2发生反应:2CO(g)+ SO2(g) 2CO2(g)+S(g)。实验测得生成的CO2的体积分数(ψ)随着时间的变化曲线如图所示:

①达到平衡时,SO2的转化率为_____________。
②该温度下反应的平衡常数K=______________。
③其它条件保持不变,再向上述平衡体系中充入CO(g)、SO2(g)、CO2(g)、S(g)各0.2mol,此时v(正)_________v(逆)。(填>、<或=)
(3)SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g) △H<0。在催化剂作用下,NO转化率与温度的关系如图所示:
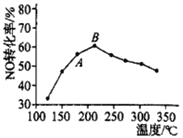
①图中A点处NO的转化率______(填“可能是”、“一定是”或“一定不是”)该温度下的平衡转化率。
②B点之后,NO转化率降低的原因可能是_________(选填字母)。
A.平衡常数变大 B.副反应增多
C.催化剂活性降低 D.反应的活化能增大
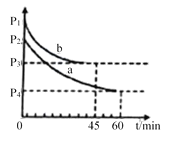
(4)2SO2(g)+O2(g) 2SO3(g) △H=-198 kJ/mol是制备硫酸的重要反应。在VL恒容密闭容器中充入2molSO2和1molO2,在不同条件下进行反应,反应体系总压强随时间的变化如图所示。a和b平衡时,SO3体积分数较小的是_________(填“a”或“b”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com