
【题目】德国化学家哈伯在合成氨方面的研究促进了人类的发展。合成氨的工业流程如图,下列说法错误的是

A.增大压强既可以加快反应速率,又可以提高原料转化率
B.升高温度可提高平衡转化率
C.冷却过程中采用热交换有助于节约能源
D.原料循环可提高其利用率
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法不正确的是( )
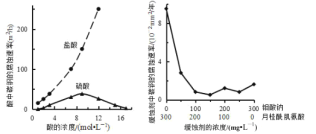
A.盐酸的浓度越大,腐蚀速率越快
B.钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
C.碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
D.对比盐酸和硫酸两条曲线,可知 Cl-也会影响碳素钢的腐蚀速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种水基二次电池原理如下式,电解液为含Zn2+的水溶液,该电池可用于电网贮能。xZn+Zn0.25V2O5﹒yH2O![]() Zn0.25V2O5﹒zH2O+(y-z)H2O。下列说法正确的是
Zn0.25V2O5﹒zH2O+(y-z)H2O。下列说法正确的是
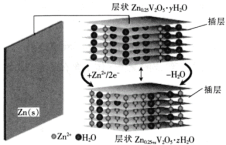
A.放电时,Zn2+脱离插层
B.放电时,溶液中Zn2+浓度一直减小
C.充电时,电子由![]() 层经电解质溶液流向
层经电解质溶液流向![]() 层
层
D.充电时,阳极反应为:Zn0.25V2O5﹒zH2O+(y-z)H2O-2xe-= Zn0.25V2O5﹒yH2O+xZn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制FeCl3溶液时,将FeCl3固体溶解在较浓的盐酸中,再加水稀释。下列说法正确的是
A.较浓盐酸可有效抑制Fe3+水解
B.稀释过程中FeCl3水解程度增大,c(H+)增大
C.FeCl3溶液中存在Fe3++3H2O=Fe(OH)3↓+3H+
D.FeCl3溶液显黄色,没有Fe(OH)3存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】花椒毒素(H)有抗实验性心律失常、镇痛、抗炎等作用。由芳香族化合物A为原料合成H的一种合成路线如下:
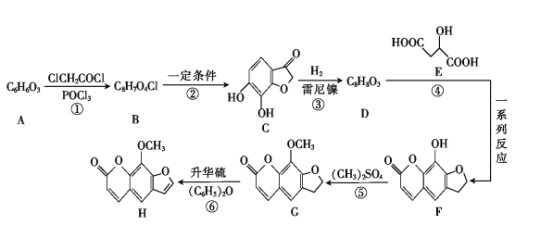
已知:![]() +ClCH2CH2Cl
+ClCH2CH2Cl![]()
![]() +HCl
+HCl
回答下列问题:
(1)A的化学名称是 _____(用系统命名法)。
(2)G中所含官能团的名称是 ____。
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。E中___ (填“有”或“没有”)手性碳。
(4)反应⑥的反应类型是 ____ 。
(5)D的结构简式为 _____。
(6)F与足量NaOH溶液反应的化学方程式为 ____。
(7)芳香族化合物W是D的同分异构体,能发生银镜反应和水解反应,遇FeCl3溶液发生显色反应;W的核磁共振氢谱有5组峰,且面积比为1∶2∶2∶2∶1。符合上述要求的W有____种。
(8)有机物M(![]() )是一种重要的化工原料。设计由邻苯二酚和氯乙酰氯(ClCH2COCl)为起始原料制备有机物M的合成路线____。(无机试剂及有机溶剂任用)
)是一种重要的化工原料。设计由邻苯二酚和氯乙酰氯(ClCH2COCl)为起始原料制备有机物M的合成路线____。(无机试剂及有机溶剂任用)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有KIO3的淀粉溶液中逐滴加入KHSO3溶液。下列说法中错误的是
A.早期滴加KHSO3溶液时发生的反应:![]() +
+![]()
![]()
![]() +I2+3H++H2O
+I2+3H++H2O
B.滴加一定量的KHSO3溶液后,溶液中可能同时含有I-和![]()
C.后期滴加KHSO3溶液,溶液中的反应为:![]() +I2+H2O
+I2+H2O![]()
![]() +2I-+3H+
+2I-+3H+
D.在不断滴加KHSO3溶液的过程中,溶液先变蓝,最终蓝色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有K+、Fe2+、Ca2+、![]() 、
、![]() 、Cl-、I-中的几种离子。根据下方实验操作与现象,推测合理的是
、Cl-、I-中的几种离子。根据下方实验操作与现象,推测合理的是
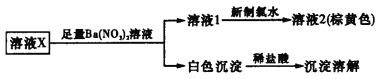
A.取溶液2,加入AgNO3溶液,可确定溶液X中是否含有Cl-
B.溶液X中一定不含Fe2+、Ca2+、![]()
C.溶液X中是否存在K+还需要通过焰色反应进一步确认
D.溶液X的溶质为K2CO3和KI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色透明的锆石(主要成分为ZrSiO4)酷似钻石,是很好的钻石代用品。锆石又称锆英石,常含有铁、铝、铜的氧化物杂质。工业上一种以锆英石为原料制备ZrO2的工艺流程如图所示:
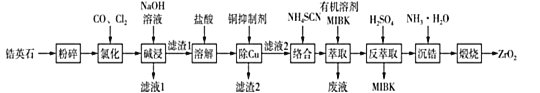
己知:i.Zr在化合物中通常显+4价,“氯化”过程中除C、O元素外,其他元素均转化为高价氯化物;
ii.SiC14极易水解生成硅酸;ZrC14易溶于水,390℃升华;
iii.Fe(SCN)3难溶于有机溶剂MIBK,Zr(SCN)4在水中的溶解度小于在有机溶剂MIBK中的溶解度。
请回答下列问题:
(1)“粉碎”锆英石的目的为 ___。
(2)①“氯化”过程中,锆英石发生的主要反应的化学方程式为 ___。
②“氯化”过程中ZrC14的产率与温度、压强的关系如图所示:

由图可知,“氯化”过程选择的最佳条件为____,“氯化”温度超过390℃时,ZrC14产率降低的原因为 ___。
(3)“滤液1”中含有的阴离子除OH-、Cl-外,还有 _______。
(4)①常用的铜抑制剂有NaCN(氰化钠),NaCN可与铜离子反应生成Cu(CN)2{Ksp[Cu(CN)2]=4×10-10}沉淀。己知盐酸溶解后的溶液中Cu2+的浓度为1 molL-1,当溶液中Cu2+浓度不大于1×10-6 molL-1时即达到后续生产的要求,则欲处理1L该溶液至少需要2molL-1的NaCN溶液的体积为____L(溶液混合时的体积变化忽略不计,计算结果保留两位小数)。
②由于氰化钠有剧毒,所以需要对“废液”中的氰化钠进行处理,通常选用漂白粉或漂白液在碱性条件下将氰化钠氧化,其中一种产物为空气的主要成分。请写出在碱性条件下漂白液与氰化钠反应的离子方程式____。
(5)通过“萃取”“反萃取”可以分离铁,富集锆,原理为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,中国科学院大连物化所CO2催化转化为CO的研究获得新成果。如图是使用不同催化剂(NiPc和CoPc)时转化过程中的能量变化。下列说法不合理的是( )
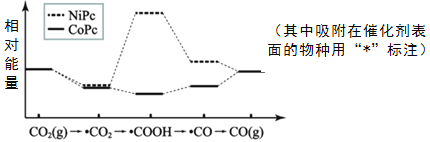
A.转化过程中有极性键形成
B.*CO2经氧化反应得到*COOH
C.吸附在NiPc和CoPc表面带有相同基团的物种其能量不同
D.该研究成果有利于缓解温室效应并解决能源转化问题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com