
| 实 验 试剂如下: | 溶 液 温 度 | 中和热△H | ||||
| t1 | t2 | |||||
| ① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.3℃ | ||
| ② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | ||
| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.1 | 3.1 | 8.1 |
分析 Ⅰ.(1)根据中和热测定的实验步骤选用需要的仪器,然后判断还缺少的仪器;
(2)金属导热快,热量损失多;
(3)①先求出2次反应的温度差的平均值,根据公式Q=cm△T来求出生成0.025mol的水放出热量,最后根据中和热的概念求出中和热;
②根据中和热的概念以及热化学方程式的书写方法解答;
Ⅱ.(1)0.10mol/L KHC2O4溶液pH约为3,溶液显酸性,草酸根离子电离大于水解;
(2)化合价有变化的是碳元素和锰元素,根据化合价变化配平;
(3)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,导致标准溶液氢氧化钠的体积增大,测定、KHC2O4的含量增大,草酸含量减小;
(4)原溶液无色,KMnO4为紫红色,当溶液中的H2C2O4和KHC2O4反应完全时,溶液呈紫红色且半分钟颜色不变;
(5)(i)常温下0.01mol/L的H2C2O4pH为2.1,KHC2O4的pH为3.1,说明草酸是二元弱酸;
(ii)HC2O4-既能够电离也能够水解,KHC2O4溶液显酸性,说明HC2O4-的电离程度大于水解程度;
(iii)a.根据物料守恒判断;
b.根据物料守恒、电荷守恒判断;
c.根据电荷守恒判断;
d.若恰好反应,c(K+)=c(Na+),此时溶液呈碱性,故加入的氢氧化钠的物质的量略少些.
解答 解:Ⅰ.(1)中和热的测定过程中,需要用量筒量取酸溶液、碱溶液的体积,需要使用温度计测量温度,所以还缺少温度计和量筒,
故答案为:量筒、温度计;
(2)不能将环形玻璃搅拌棒改为铜丝搅拌棒,因为铜丝搅拌棒是热的良导体,金属易导热,热量散失导致误差大,
故答案为:否;金属易导热,热量散失导致误差大;
(3)①第1次反应前后温度差为:3.3℃,第2次反应前后温度差为:3.5℃,平均温度差为3.4℃,
50mL0.55mol•L-1NaOH与50mL0.5mol•L-1HCl混合,氢氧化钠过量,反应生成了0.025mol水,50mL0.5mol•L-1 盐酸、0.55mol•L-1NaOH溶液的质量和为:m=100mL×1g/mL=100g,c=4.18J/(g•℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g•℃)×100g×3.4℃=1.4212kJ,即生成0.025mol的水放出热量1.4212kJ,所以生成1mol的水放出热量为1.4212÷0.025=56.8kJ,即该实验测得的中和热△H=-56.8kJ•mol-1,
故答案为:-56.8kJ•mol-1;
②稀盐酸和NaOH稀溶液反应生成1mol水放热56.8KJ,该反应的热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-56.8kJ•mol-1,
故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-56.8kJ•mol-1;
Ⅱ.(1)0.10mol/L KHC2O4溶液pH约为3,溶液显酸性,草酸根离子电离大于水解,含碳元素粒子浓度由大到小的顺序为:c(HC2O4-)>c(C2O42-)>c(H2C2O4),故答案为:c(HC2O4-)>c(C2O42-)>c(H2C2O4);
(2)化合价C:+3→+4,改变量(4-3)×2=2,Mn:+7→+2,改变量(7-2)×1=5,根据化合价升降总数相等,所以在C2O42-前配5,MnO4-前配2,根据C和Mn原子守恒,分别在CO2和Mn2+前配10和2,根据电荷守恒,在H+前配16,最后根据离子方程式两边的H个数相等,结合原子守恒,缺少项是水,水前面配8,经检验离子方程式两边的氧原子相等,得到离子方程式为:5C2O42++2MnO4-+16H+=10CO2+2Mn2++8H2O;
故答案为:5;2;16;10;2;8H2O;
(3)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,导致标准溶液氢氧化钠的体积增大,测定KHC2O4的含量增大,草酸含量减小;
故答案为:偏小;
(4)原溶液无色,而KMnO4为紫红色,所以当溶液中的H2C2O4和KHC2O4反应完全时,滴入最后一滴溶液呈紫红色且半分钟颜色不变;
故答案为:滴入最后一滴溶液呈紫红色且半分钟颜色不变;
(5)(i)二元弱酸分步电离,草酸电离方程式为:H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-,
故答案为:H2C2O4?H++HC2O4-;HC2O4-?H++C2O42-;
(ii)HC2O4-?H++C2O42-,HC2O4-+H2O?H2C2O4+OH-,HC2O4-既能够电离也能够水解,KHC2O4溶液显酸性,说明HC2O4-的电离程度大于水解程度,
故答案为:HC2O4-?H++C2O42-,HC2O4-+H2O?H2C2O4+OH-,但其电离程度大于水解程;
(iii)a.碳元素在溶液中存在形式有:HC2O4-、H2C2O4、C2O42-,根据物料守恒有c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-),故a正确;
b.由c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)、c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-)可知,c(Na+)=c(C2O42-)-c(H2C2O4),故b错误;
c.根据电荷守恒有:c(K+)+c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),溶液呈中性,则c(H+)=c(OH-),故c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-),故c错误;
d.若恰好反应,c(K+)=c(Na+),此时溶液呈碱性,故加入的氢氧化钠的物质的量略少些,故c(K+)>c(Na+),故d正确;
故答案为:ad.
点评 本题考查中和热的测定,题目难度不大,注意热量计算公式的应用中c=4.18J/(g•℃),要注意热量单位的换算;通过草酸考查了多元弱酸的电离方程式书写、电解质溶液中的电荷守恒和物料守恒、草酸的还原性,题目难度较大.


科目:高中化学 来源: 题型:解答题
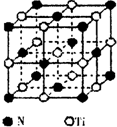 钛铁合金具有吸氢特性,在制造以氢为能源的热泵和蓄电池等方面有广阔的应用前景.
钛铁合金具有吸氢特性,在制造以氢为能源的热泵和蓄电池等方面有广阔的应用前景.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质的电离方程式为KHXOn═K++H++XOn2- | |
| B. | 该溶液中水的电离程度比纯水的小 | |
| C. | 该溶液能与NaOH溶液发生中和反应 | |
| D. | 若该溶液显酸性,则K1•K2>10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 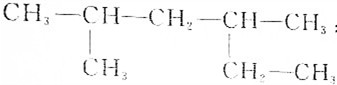 :2,4-二甲基已烷 :2,4-二甲基已烷 | |
| B. | 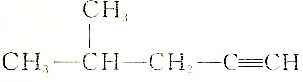 :2-甲基-4-戊炔 :2-甲基-4-戊炔 | |
| C. | 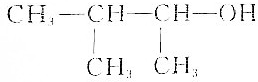 :3-甲基-2-丁醇 :3-甲基-2-丁醇 | |
| D. | CH2-CHBr-CHBr-CH3:2,3-二溴丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
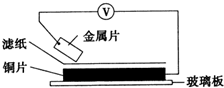 将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下:
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下:| 金属 | 电子流动方向 | 电压/V |
| 甲 | 甲→Cu | +0.78 |
| 乙 | Cu→乙 | -0.15 |
| 丙 | 丙→Cu | +1.35 |
| 丁 | 丁→Cu | +0.30 |
| A. | 在四种金属中丙的还原性最强 | |
| B. | 金属乙能从硫酸铜溶液中置换出铜 | |
| C. | 甲、丁若形成原电池时,甲为正极 | |
| D. | 甲、乙形成合金时,将该合金露置在空气中,乙先被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3溶液(H2SO4),适量BaCl2溶液,过滤 | |
| B. | Fe2+(Fe3+),还原铁粉,过滤 | |
| C. | Cl2(HCl),饱和食盐水,洗气 | |
| D. | CO2(SO2),饱和NaHCO3溶液、浓硫酸,洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:6I-+8H++2NO3-=3I2+4H2O+2NO↑ | |
| B. | 非金属元素形成的化合物一定是共价化合物 | |
| C. | SO2通入Ca(ClO)2溶液中:SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO | |
| D. | 只含有共价键的物质一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
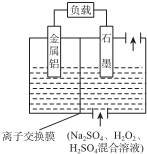
| A. | 铝作该电源的负极,电极反应为:Al-3e-═Al3+ | |
| B. | 电池总反应:2Al+3H2O2+6H+═2Al3++6H2O | |
| C. | 放电时溶液中的SO42-向正极移动 | |
| D. | 放电时正极周围溶液的pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀硫酸和锌粒反应制取氢气时加入少许硫酸铜粉末以加快反应速率 | |
| B. | 向乙酸乙酯中加入饱和碳酸钠溶液以除去乙酸乙酯中少量的乙酸 | |
| C. | 向盛有沸水的烧杯中滴加FeC13饱和溶液并长时间煮沸以制取Fe(OH)3胶体 | |
| D. | 向蔗糖中滴加浓硫酸可证明浓硫酸有脱水性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com