
科目:高中化学 来源: 题型:选择题
| A. | 青蒿素由碳、氢、氧三种元素组成 | |
| B. | 青蒿素分子中碳、氢、氧的原子个数比为:15:22:5 | |
| C. | 青蒿素中碳、氢、氧三种元素的质量比为:90:11:40 | |
| D. | 青蒿素的相对分子质量为282g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用C8H18萃取溴水中的溴,可观察到溶液分层,上层为橙红色,下层接近无色 | |
| B. | 有机物一定含碳、氢元素,可能含有氧、硫等元素 | |
| C. | 在石油的分馏实验中,温度计的水银球插入石油中以测液体的温度 | |
| D. | 石油的裂化、裂解、分馏与煤的干馏均属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3 | B. | NaHCO3 | C. | MgSO4 | D. | Na2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
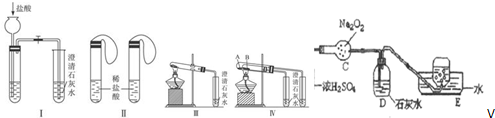
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com