
| A. | 进入煤矿矿井时用火把照明 | |
| B. | 实验室在通风橱中制备氯气 | |
| C. | 将水倒入浓硫酸配制稀硫酸 | |
| D. | 用点燃的火柴在液化气钢瓶口检验是否漏气 |
分析 A.煤矿井下经常有可燃性气体;
B.为了防止中毒,制备有毒气体的实验时,要及时将气体排出;
C.浓硫酸的稀释是放热的,将水倒入浓硫酸配制稀硫酸会引起液体飞溅;
D.可燃性气体遇到明火会产生爆炸.
解答 解:A.煤矿井下经常有可燃性气体,用火把照明可能使气体产生爆炸,故A错误;
B.为了防止中毒,制备有毒气体的实验时,要及时将气体排出,所以要在通风橱中进行,故B正确;
C.配制稀硫酸时,先在烧杯内倒入蒸馏水,再沿烧杯内壁缓慢注入浓硫酸,并不断搅拌,防止液体飞溅,故C错误;
D.若有漏气,用点燃的火柴在液化气钢瓶口检验是否漏气会引起爆炸,故D错误.
故选B.
点评 本题考查化学实验室安全及事故处理,该题是基础性试题的考查,难度不大,侧重对学生实验基础知识的检验和训练,有利于培养学生的实验能力.在实验过程中应学会处理常见意外事故的方法技巧.


科目:高中化学 来源: 题型:解答题
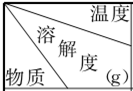 | 20℃ | 60℃ | 100℃ |
| Na2Cr2O7 | 73.2 | 82.0 | 91.4 |
| K2Cr2O7 | 13.1 | 50.5 | 96.2 |
| NaCl | 36 | 37 | 39 |
| KCl | 34 | 45.5 | 56.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用电解饱和MgCl2溶液的方法获得金属镁 | |
| B. | 电解法精炼粗铜,用粗铜作阳极,纯铜作阴极 | |
| C. | 电解熔融Al2O3制备金属铝时,加入冰晶石使Al2O3更易熔化 | |
| D. | 氯碱工业中电解食盐水时,阳离子交换膜可防止氯气与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 伏打电堆(Voltaic pile)的照片和结构如图.它用圆形的锌板、铜板间隔堆积而成.所有的圆板之间夹放几层盐水泡过的布.下列说法正确的是( )
伏打电堆(Voltaic pile)的照片和结构如图.它用圆形的锌板、铜板间隔堆积而成.所有的圆板之间夹放几层盐水泡过的布.下列说法正确的是( )| A. | 伏打电堆能将电能转化成化学能 | B. | 锌是正极 | ||
| C. | 盐水是电解质溶液 | D. | 伏打电堆工作时铜被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是生产有机玻璃的单体.
)是生产有机玻璃的单体. .
. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$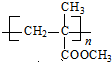 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
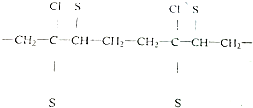
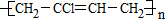 _.
_.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
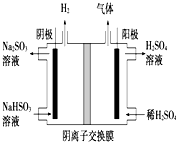 硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.不同温度下,反应的平衡常数如表:
硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.不同温度下,反应的平衡常数如表:| 温 度 | 200℃300℃400℃ |
| 平衡常数 | K1 K2 K3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com