
【题目】CO是火力发电厂释放出的主要尾气,为减少对环境污染,发电厂试图采用CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2 , 在催化剂的作用下发生反应:CO(g)+Cl2(g)COCl2(g)△H=a kJ/mol
反应过程中测定的部分数据如下表:
t/min | n (CO)/mol | n (Cl2)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
(1)反应0~2min末的平均速率v(COCl2)=mol/(Lmin).
(2)在2min~4min间,v(Cl2)正v(Cl2)逆 (填“>”、“=”或“<”),该温度下K= .
(3)在图1中画出0~4min末n(COCl2)随时间的变化示意图 
(4)已知X、L可分别代表温度或压强,如图2表示L一定时,CO的转化率随X的变化关系.X代表的物理量是;a0 (填“>”,“=”,“<”),依据是 
【答案】
(1)0.1
(2)=;5
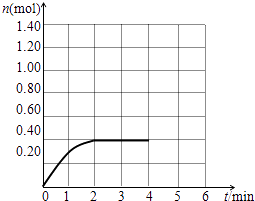
(3)
(4)温度;<;因为X增大时,CO的平衡转化率降低,平衡逆向移动
【解析】解:(1.)由表中数据,可知0~2min内△n(CO)=1.2mol﹣0.8mol=0.4mol,由方程式可知△c(COCl2)=△c(CO)=0.4mol,则v(COCl2)= ![]() 0.1mol/(L.min),故答案为:0.1;
0.1mol/(L.min),故答案为:0.1;
(2.)4min内,反应的氯气为0.6mol﹣0.2mol=0.4mol,由方程式可知参加反应的CO为0.4mol,故4min时CO为1.2mol﹣0.4mol=0.8mol,与2min时CO的物质的量相等,则2min、4min处于平衡状态,在2min~4min间,v(Cl2)正=v(Cl2)逆 ,
由方程式可知,平衡时生成COCl2为0.4mol,该温度下平衡常数K= ![]() =
= ![]() =5,故答案为:=;5;
=5,故答案为:=;5;
(3.)随时间的变化,COCl2的物质的量增大,开始为0,2min时到达平衡,平衡时COCl2为0.4mol,0~4min末n(COCl2)随时间的变化示意图为:  ,
,
故答案为:  ;
;
(4.)正反应为气体体积减小的反应,增大压强平衡正向移动,CO转化率增大,而图中随X增大时,CO的平衡转化率降低,平衡逆向移动,则X为温度,正反应为放热反应,故a<0,
故答案为:温度;<;因为X增大时,CO的平衡转化率降低,平衡逆向移动.
(1.)由表中数据,可知0~2min内△n(CO)=1.2mol﹣0.8mol=0.4mol,由方程式可知△c(COCl2)=△c(CO)=0.4mol,再根据v= ![]() 计算v(COCl2);
计算v(COCl2);
(2.)4min内,反应的氯气为0.6mol﹣0.2mol=0.4mol,由方程式可知参加反应的CO为0.4mol,故4min时CO为1.2mol﹣0.4mol=0.8mol,与2min时CO的物质的量相等,则2min、4min处于平衡状态;由方程式可知,平衡时生成COCl2为0.4mol,平衡常数K= ![]() ;
;
(3.)n(COCl2)随时间的变化增大,开始为0,2min时到达平衡,平衡时COCl2为0.4mol;
(4.)正反应为气体体积减小的反应,增大压强平衡正向移动,CO转化率增大,而图中随X增大时,CO的平衡转化率降低,平衡逆向移动,则X为温度,正反应为放热反应.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】在一密闭烧瓶中,在25℃时存在着平衡:2NO2N2O4(正反应放热).把烧瓶置于100℃的水中,则下列几项性质中不会改变的是( ) ①颜色;②平均分子量;③质量;④压强;⑤密度.
A.①和③
B.②和④
C.④和⑤
D.③和⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一包由3.2g铜、13g锌和2g 碳组成的粉末,放到一定量的AgNO3溶液中,完全反应后得到的固体为m种,溶液中溶质为n种.下列说法中不正确的是( )
A. 若m=2,则n=2或3 B. 若固体中金属的质量为 48g,则m=4
C. 当m=3时,溶液可能呈蓝色 D. 反应后固体的质量不可能超过56g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据20℃时某些物质的溶解度(g)数据:
CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
1.4×10﹣3 | 2.55×10﹣2 | 9×10﹣4 | 1.1×10﹣2 |
下列说法不正确的是( )
A.硫酸钙悬浊液中存在CaSO4(s)Ca2+(aq)+SO42﹣(aq)
B.用Na2CO3溶液浸泡锅炉中的水垢,可将水垢中的CaSO4转化为CaCO3
C.向Mg(OH)2悬浊液中滴加FeCl3 , 沉淀变为红褐色,说明溶解度Fe(OH)3<Mg(OH)2
D.向2ml饱和MgCl2 溶液中先后滴加0.1mol/L的Na2CO3、NaOH溶液各2滴,产生的白色沉淀为Mg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法表示更便于理解.下列表达正确的是( )
A.Na2CO3溶液和盐酸反应后溶液中的钠盐:![]()
B.NaOH溶液与CO2反应后溶液中的钠盐:
C.Fe与稀硝酸反应的氧化产物:
D.AlCl3溶液中滴加氨水后铝元素的存在形式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值.下列判断正确的是( )
A.32克O2和O3组成的混合气体中含有的氧原子数目为2NA
B.常温常压下,22.4 L乙醇含有的分子数目为NA
C.1 mol Na变为Na+时得到的电子数目为NA
D.44克14C16O2含氧原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析城市空气样本,主要污染物为可吸入颗粒物pm2.5、SO2、NOx等,其主要来源为燃煤和机动车尾气排放等.
某同学为检测样本中所含成份,将样本用蒸馏水处理制成待测试样,设计实验及实验现象如下: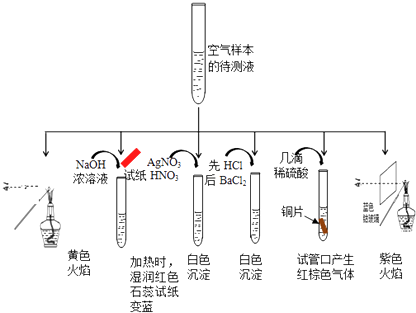
①该实验能确认存在的阳离子是 .
②该实验检测出样本中有NO3﹣ , 根据是(用化学方程式解释) .
③根据该实验能否确定样本中含有SO32﹣ , (填“能”或“否”),若要确定SO32﹣ , 所需的实验药品可以是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A.Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I﹣═2Fe2++I2+3H2O
B.0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合:Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+AlO2﹣+2H2O
C.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO ![]() ?+6H++5H2O2═2Mn2++5O2↑+8H2O
?+6H++5H2O2═2Mn2++5O2↑+8H2O
D.向次氯酸钠溶液中通入足量SO2气体:ClO﹣+SO2+H2O═HClO+HSO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )
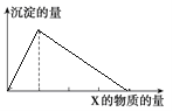
A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com