
【题目】下列关于平衡常数K的说法中,正确的是( )
①平衡常数K只与反应本身及温度有关
②改变反应物浓度或生成物浓度都会改变平衡常数K
③加入催化剂不改变平衡常数K
④平衡常数K只与温度有关,与反应的本身及浓度、压强无关
A. ①② B. ②③ C. ③④ D. ①③
科目:高中化学 来源: 题型:
【题目】某实验小组以粗镍(含少量Fe和Cr杂质)为原料制备Ni(NH3)6Cl2,并测定相关组分的含量。制备流程示意图如下:
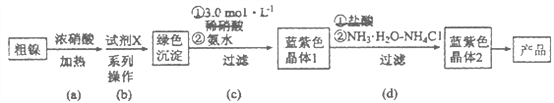
已知:①部分离子生成氢氧化物沉淀的pH(开始沉淀的pH按离子浓度为0.1 mol·L-1计算)如下表所示:
离子 | Fe3+ | Cr3+ | Ni2+ |
开始沉淀pH | 1.5 | 4.3 | 6.9 |
完全沉淀pH | 2.8 | 5.6 | 8.9 |
②Ni(OH)2为绿色难溶物。Ni(NH3)6(NO3)2、Ni(NH3)6Cl2均为可溶于水的蓝紫色晶体,水溶液均显碱性。
回答下列问题:
(1)实验需要配制3.0mol·L-1稀硝酸250mL,需要的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管和_________________。
(2)步骤(a)中Ni和浓硝酸反应的化学方程式为________________。
(3)步骤(b)首先加入试 剂X调节溶液的pH约为6,过滤后再继续加入X调节pH以得到绿色沉淀。
①调节pH约为6的原因是_______________________________________________。
②试剂X可以是__________________(填标号)。
A. H2SO4 B. Ni(OH)2 C. NaOH D. Fe2O3 E. NiO
(4)NH3含量的测定
i. 用电子天平称量mg产品于锥形瓶中,用25mL水溶解后加入3.00mL 6 mol/L盐酸,以甲基橙作指示剂,滴定至终点消耗0.500 0 mol·L-1NaOH标准溶液V1mL;
ii. 空白试验:不加入样品重复实验i,消耗NaOH标准溶液V2mL。
NH3的质量分数为____________。(用V1 ,V2表示)
②在上述方案的基础上,下列措施能进一步提高测定准确度的有____________(填标号)。
A. 适当提高称量产品的质量 B. 用H2SO4溶液替代盐酸
C. 用酚酞替代甲基橙 D. 进行平行实验
(5)为测定Cl-的含量,请补充完整下述实验方案。
称量mg产品于锥形瓶中,用25mL水溶解,________________,滴入2~3滴K2CrO4溶液作指示剂,用已知浓度的AgNO3标准溶液滴定至终点,记录读数,重复操作2~3次。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊溶液。下列实验现象中错误的是( )
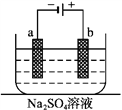
A. 电子的流向:负极→a电极→b电极→正极
B. a电极附近呈蓝色,b电极附近呈红色
C. 逸出气体的体积,a电极的大于b电极的
D. Na+向a极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. O3是由3个氧原子构成的化合物
B. 稀H2SO4能导电,所以稀H2SO4是电解质
C. 根据交叉分类法MgSO4既是镁盐又是硫酸盐
D. 根据是否有丁达尔效应将分散系分为溶液、胶体和浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在特定条件下一定能够大量共存的是
A. 含有较多Fe3+的溶液:Na+、SO42-、HS-、NH4+
B. c(OH-)=1mol/L的溶液:AlO2-、CH3COO-、K+、Ba2+
C. pH=1的溶液:K+、Fe2+、NO3-、Na+
D. 遇Al能放出H2的溶液:HCO3-、K+、Mg2+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作或试剂的选择合理的是
A.铁丝能代替铂丝来做焰色反应实验
B.容量瓶用蒸馏水洗涤后须烘干才能使用
C.用分液漏斗分离苯和CCl4混合物
D.用Ba(OH)2溶液鉴别SO2和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NO2装入带活塞的密闭容器中,当反应2NO2(g)![]() N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是( )
N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是( )
A. 升高温度,气体颜色加深,则此反应为吸热反应
B. 慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅
C. 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D. 恒温恒容时,充入惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有机物结构和性质的描述错误的是( )
A. 光照下,异丁烷与Cl2发生取代反应生成的一氯代物有2种
B. 丙烯分子中所有原子不可能在同一平面上
C. 某烃的结构简式可表示为![]() (碳原子数≤10)。已知烃分子中有两种化学环境不同的氢原子,且数目之比为3∶2,则该烃一定是苯的同系物
(碳原子数≤10)。已知烃分子中有两种化学环境不同的氢原子,且数目之比为3∶2,则该烃一定是苯的同系物
D. 卤代烃、糖类和蛋白质均可发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(前两空每空2分,后三空每空3分,共13分)氮气与氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
(1)取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量___(填“大于”“等于”或“小于”)92 kJ,原因 是______________;若加入催化剂,ΔH___(填“变大”“变小”或“不变”)。
(2)已知:破坏1 mol N≡N键、1 mol H—H键需要吸收的能量分别为:946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为_____kJ。
(3)N2H4可视为NH3分子中的一个H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,NO2为氧化剂,生成N2和H2O(g)。
已知:N2(g)+2O2(g)![]() 2NO2(g) ΔH1=+67.7 kJ·mol-1
2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)![]() N2(g)+2H2O(g)ΔH2=-534 kJ·mol-1。
N2(g)+2H2O(g)ΔH2=-534 kJ·mol-1。
则:1 mol N2H4与NO2完全反应的热化学方程式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com