
分析 (1)含有弱酸HA和其钠盐NaA的混合溶液,向其中加入少量酸或碱时,溶液的酸碱性变化不大,是由于加入酸时生成弱电解质,加入碱时生成正盐,溶液中氢离子或氢氧根离子浓度变化不大而起到缓冲作用;
(2)①从溶液电中性的角度比较离子浓度大小;
②若HA为CH3COOH,该溶液显酸性,说明c(H+)>c(OH-),结合溶液电中性原则分析;
(3)A、加入碱,碱能和酸式酸根离子反应;
B、加入酸,磷酸根离子和氢离子反应生成磷酸一氢根离子;
C、根据电荷守恒判断正误;
D、根据物料守恒和极限的方法分析解答,只要Na2HPO4/Na3PO4的量一定,溶液中所有的含有P原子的微粒之和为一定值;
(4)“缓冲溶液”中加入少量的强酸或强碱,溶液的pH变化都不大,加入强酸时氢离子与碳酸根离子反应,加入碱时与碳酸氢根离子反应;
解答 解:(1)含有弱酸HA和其钠盐NaA的混合溶液,向其中加入少量酸或碱时,溶液的酸碱性变化不大,是由于加入酸时发生:A-+H+?HA,加入碱时发生:HA+OH-?H2O+A-,溶液中氢离子或氢氧根离子浓度变化不大而起到缓冲作用,
故答案为:A-+H+?HA;HA+OH-?H2O+A-;
(2)①该溶液显碱性,则c(H+)<c(OH-),根据溶液电中性原则可知c(Na+)+c(H+)=C(CN-)+c(OH-),
则c(Na+)>c(CN-),
故答案为:>,因为c(Na+)+c(H+)=C(CN-)+c(OH-),溶液显碱性,则c(H+)<c(OH-),所以c(Na+)>c(CN-);
②若HA为CH3COOH,该溶液显酸性,说明c(H+)>c(OH-),根据溶液电中性原则可知c(CH3COO-)>c(Na+),
故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
(3)A、当加入少量碱时,溶液中氢氧根离子和HPO42-发生中和反应生成PO43-,故A正确;
B、当加入少量酸时,发生的反应为PO43-+H+=HPO42-,故B错误;
C、溶液呈电中性,即阴阳离子所带电荷总数相等,所以c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-),故C正确;
D、只要Na2HPO4/Na3PO4的量一定,溶液中所有的含有P原子的微粒之和为一定值,当溶质为Na2HPO4时,C(Na+):[c(PO43-)+c(HPO42-)+c(H2PO4-)+c(H3PO4)]=2;当溶质为Na3PO4,C(Na+):[c(PO43-)+c(HPO42-)+c(H2PO4-)+c(H3PO4)]=3,所以Na2HPO4/Na3PO4的混合溶液中$\frac{1}{2}$C(Na+)>c(PO43-)+c(HPO42-)+c(H2PO4-)+c(H3PO4)>$\frac{1}{3}$c(Na+),故D正确.
故选B,
故答案为:B;
(4)“缓冲溶液”中加入少量的强酸或强碱,溶液的pH变化都不大,加入强酸时氢离子与碳酸根离子反应,离子方程式为:CO32-+H+=HCO3-,加入碱时与碳酸氢根离子反应,该离子反应为HCO3-+OH-=H2O+CO32-,
故答案为:CO32-+H+=HCO3-;HCO3-+OH-=H2O+CO32-.
点评 本题考查离子浓度大小比较、缓冲溶液中离子浓度大小的比较、电荷守恒等知识点,题目难度中等,注意缓冲溶液的原理.难点是判断溶液中离子浓度大小的关系,会运用电荷守恒和物料守恒是解本题的关键,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| ① | 检验淀粉是否水解生成葡萄糖 | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后水解液用NaOH溶液中和,然后再加入新制Cu(OH)2浊液,加热,观察是否有红色沉淀生成 |
| ② | 比较H2CO3、HCN的酸性强弱 | 用pH计测定同温度同浓度的Na2CO3溶液和NaCN溶液 的pH值,比较pH大小 |
| ③ | 区别植物油和矿物油 | 向植物油和矿物油中分别加入烧碱溶液,加热,冷却后观察是否分层 |
| ④ | 验证CaCO3的溶解度小于CaSO4 | 将浓Na2CO3溶液加入CaSO4悬浊液中,充分振荡,过滤、洗涤,向所得固体中滴加盐酸,观察是否有气体生成 |
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
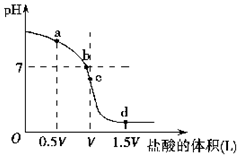 经测定某溶液中只含NH4+、Cl-、H+、OH-四种离子,已知这种溶液中含有一种或两种溶质.查资料表明等物质的量浓度的氨水和氯化铵溶液等体积混合后溶液显碱性,试完成下列各题.
经测定某溶液中只含NH4+、Cl-、H+、OH-四种离子,已知这种溶液中含有一种或两种溶质.查资料表明等物质的量浓度的氨水和氯化铵溶液等体积混合后溶液显碱性,试完成下列各题.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗盐提纯时,为了加快过滤速率,可以用玻璃棒进行搅拌 | |
| B. | 分液操作中,将下层液体放入烧杯中,再将上层液体继续放入另一烧杯中 | |
| C. | 测定硫酸铜晶体结晶水含量时,加热后的坩埚须在干燥器中冷却,再称量 | |
| D. | 蒸馏操作中,温度计水银球部位要插入液面下且不接触蒸馏烧瓶瓶壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A-x | B. | A+n-x | C. | A-n-x | D. | A+n+x |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
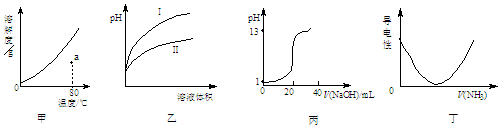
| A. | 图甲表示KNO3的溶解度曲线,a点所示溶液是80℃时KNO3的不饱和溶液 | |
| B. | 图乙表示用水稀释pH相同的盐酸和醋酸,I表示醋酸,II表示盐酸 | |
| C. | 图丙表示0.1000 mol•L-1NaOH溶液滴定20.00 mL 0.1000 mol•L-1CH3COOH溶液所得到的滴定曲线 | |
| D. | 图丁表示将NH3通入醋酸溶液的过程中,溶液导电性的变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com