
分析 (1)依据配制一定物质的量浓度溶液步骤选择需要仪器;
(2)依据m=CVM计算需要溶质的质量;依据稀释前后溶质的物质的量不变计算需要硫酸铜的体积,依据硫酸铜体积选择量筒规格;
(3)依据配制一定物质的量浓度溶液步骤排序;
(4)分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制一定物质的量浓度溶液步骤有:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,用到的仪器有:托盘天平、药匙、烧杯、玻璃棒
250mL容量瓶,必须用到的还有250mL容量瓶;
故答案为:250mL容量瓶;
(2)配制0.2mol/L CuSO4溶液250mL,需要CuSO4•5H2O的质量m=0.2mol/L×0.25L×250g/mol=12.5g;
如果用5mol/L的CuSO4溶液稀释配制,设需要浓硫酸铜溶液的体积为V,依据稀释前后溶质的物质的量不变,5mol/L×V=0.2mol/L×250mL,
解得V=10.0ml,所以应选择10ml量筒;
故答案为:12.5;10.0;
(3)用浓溶液配制一定物质的量浓度溶液步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,所以正确的顺序为:③②①⑦⑥⑤④;
故答案为:③②①⑦⑥⑤④;
(4)A.转移到容量瓶过程中,有少量的溶液流出瓶外,导致溶质的物质的量偏小,溶液浓度偏低;
B.转移后,未洗涤小烧杯和玻璃棒,或者虽洗涤但未将洗涤液一并转移至容量瓶中,导致溶质的物质的量偏小,溶液浓度偏低;
C.定容时俯视刻度线,导致溶液的体积偏小,溶液的物质的量浓度偏大;
D.定容时仰视刻度线,导致溶液的体积偏大,溶液的物质的量浓度偏小;
E.定容摇匀后转移溶液入试剂瓶时有少量溶液外流,对溶液的浓度不会产生影响,溶液浓度不变;
F.容量瓶未干燥即用来配制溶液,对溶质的物质的量和溶液的体积都不会产生影响,溶液的浓度不变;
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线,导致溶液的体积偏大,溶液的浓度偏小;
故选:ABDG.
点评 本题考查了配制一定物质的量浓度的溶液的方法,明确配制原理是解题关键,注意量筒、容量瓶规格的选择依据.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:解答题
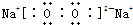

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
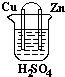
| A. | 铜片作正极,锌片作负极 | |
| B. | 该电池工作时,锌失电子变为Zn2+进入溶液 | |
| C. | 该电池工作时,电子由锌片流向铜片 | |
| D. | 该电池工作时,H+在锌片上得电子被还原生成H2逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可通过控制溶液的pH降低氨基酸的熔点,分离不同氨基酸 | |
| B. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 | |
| C. | 所有的糖类、油脂和蛋白质均能发生水解反应 | |
| D. | 利用二氧化碳制造全降解塑料能有效减少“白色污染” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,浓硫酸、浓硝酸均能将金属铜氧化,且均能使铁钝化 | |
| B. | 乙烯常用作植物催熟剂,乙酸常用作调味剂,乙醇常用于杀菌消毒 | |
| C. | 玛瑙、水晶、钻石的主要成分均为SiO2 | |
| D. | 用CCl4萃取碘水中的I2时,紫色溶液从分液漏斗的上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 除去乙烷中混有的乙烯,加氯气光照 | |
| B. | 除去乙烯中混有的水蒸气,通过盛有浓硫酸的洗气瓶 | |
| C. | 除去乙烷中混有水蒸气,通过碱石灰的干燥管 | |
| D. | 除去乙烯中混有的少量SO2,通过KMnO4酸性溶液后再干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH2Br-CH2Br可作汽油抗爆剂的添加剂,常温下是无色液体,温度2.18g•cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.试管b中装有液溴(表面覆盖少量水).工业用乙烯中含少量H2S气体.利用工业乙烯通过下列装置可制备少量CH2B-CH2Br
CH2Br-CH2Br可作汽油抗爆剂的添加剂,常温下是无色液体,温度2.18g•cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.试管b中装有液溴(表面覆盖少量水).工业用乙烯中含少量H2S气体.利用工业乙烯通过下列装置可制备少量CH2B-CH2Br查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH和CH3OCH3 | B. | HCOOH和C17H33COOH | ||
| C. | CH3CH2CH2Br和CH3CHBrCH3 | D. |  和 和 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com