
| A. | CH3CH2OH→CH2=CH2↑+H2O | |
| B. | CH3CHBrCH3+NaOH→CH3CH=CH2↑+NaBr+H2O | |
| C. |  CHClCH2Cl+2NaOH→ CHClCH2Cl+2NaOH→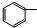 C≡CH+2NaCl+2H2O C≡CH+2NaCl+2H2O | |
| D. | 2CH3OH→CH3-O-CH3+H2O |
分析 有机物中脱去一个或几个小分子(如水、卤化氢等分子),而生成不饱和(碳碳双键或三键或苯环状)化合物的反应,叫做消去反应,结合有机物结构判断.
解答 解:A.乙醇脱去一个水,生成不饱和的CH2=CH2,属于消去反应,故A不选;
B.2-溴丙烷与氢氧化钠醇溶液共热生成不饱和的CH3CH=CH2,属于消去反应,故B不选;
C. CHClCH2Cl与氢氧化钠醇溶液反应生成不饱和的
CHClCH2Cl与氢氧化钠醇溶液反应生成不饱和的 C≡CH,属于消去反应,故C不选;
C≡CH,属于消去反应,故C不选;
D.甲醇发生分子间脱水生成二甲醚,属于取代反应,故D选;
故选D.
点评 本题考查有机反应类型,难度不大,注意对有机反应概念的理解,注意从反应中反应物和生成物的结构理解有机反应类型.


科目:高中化学 来源: 题型:解答题
 请你利用所学反应原理知识解决下列问题:
请你利用所学反应原理知识解决下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将足量Cl2通入溴化亚铁溶液:2Fe2++Cl2=2Fe3++2Cl- | |
| B. | 氯气通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| C. | AlCl3溶液中通入过量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| D. | 碳酸氢钠和稀硫酸反应:CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外的电子总是尽先排在能量高的电子层里,然后才排在能量低的电子层 | |
| B. | 某原子的核电荷数与最外层电子数相等 | |
| C. | 原子核外的电子层分为七层,每层所排的电子数相同 | |
| D. | 某原子M层上电子数是L层上电子数的4倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
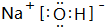 ,F溶液与足量EDA的稀溶液混合,其离子方程式为:NH4++HCO3-+OH-=NH3.H2O+2CO32-+H2O.
,F溶液与足量EDA的稀溶液混合,其离子方程式为:NH4++HCO3-+OH-=NH3.H2O+2CO32-+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25 | B. | 0.025 | C. | 30.25 | D. | 27.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | A | B | C | D | E |
| 性质 或结 构信 息 | 室温下单质呈气态,原子最外层电子数与D相同 | D3B中阳离子与阴离子的电子层结构相同 | A和C可形成两种常见的化合物甲和乙,甲有强氧化性 | 单质质软、银白色固体、导电性强,在空气中燃烧生成淡黄色固体 | E的气态氢化物和最高价氧化物对应的水化物均为强酸,C、D和E三种元素形成的一种盐丙为某消毒液的主要成分 |
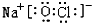 .丙在水溶液中的电离方程式NaClO=Na++ClO-.
.丙在水溶液中的电离方程式NaClO=Na++ClO-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K层电子数为偶数的所有元素所在族的序数与该元素原子的K层电子数相等 | |
| B. | L层电子数为奇数的所有主族元素所在族的序数与该元素原子的L层电子数相等 | |
| C. | L层电子数为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等 | |
| D. | M层电子数为偶数的所有主族元素所在族的序数与该元素原子的M层电子数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com