
| A. | NaHCO3 的电离:NaHCO3═Na++H++CO32- | |
| B. | HS-的电离:HS-+H2O?H3O ++S2- | |
| C. | NaClO的电离:NaClO?Na++ClO- | |
| D. | NH4Cl水解方程式 NH4++H2O═NH3•H2O+H+ |
分析 A.碳酸氢根离子为多元弱酸的酸式根离子,不能拆;
B.硫氢根离子为多元弱酸的酸式根离子,部分电离生成硫离子和氢离子;
C.次氯酸钠为强电解质,完全电离,用等号;
D.铵根离子部分水解生成一水合氨和氢离子,水解为可逆反应,用可逆号.
解答 解:A.NaHCO3 为强电解质,完全电离,电离方程式:NaHCO3═Na++HCO3-,故A错误;
B.硫氢根离子为多元弱酸的酸式根离子,部分电离生成硫离子和氢离子,电离方程式HS-+H2O?H3O ++S2-,故B正确;
C.NaClO为强电解质,完全电离,电离的电离:NaClO=Na++ClO-,故C错误;
D.NH4Cl水解方程式:NH4++H2O?NH3•H2O+H+,故D错误;
故选:B.
点评 本题考查了电解质电离方程式、盐类水解离子方程式的书写,明确电解质强弱及电离方式是解题关键,注意可逆号、等号的使用,题目难度不大.


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:实验题
 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯 | B. | 乙醇和丙醇(CH3CH2CH2OH) | ||
| C. | 乙醇和乙醚(C2H5OC2H5) | D. | 甲醛(HCHO)和乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Na2O2与2 mol NaHCO3固体混合物在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是NaOH和Na2CO3 | |
| B. | 由Na2O、Na2O2、Na2CO3.10H2O组成的混合物0.05 mol,溶于水后加入50 mL 1 mol/L的硫酸恰好完全反应,则原混合物中各成分的物质的量之比可为任意值 | |
| C. | 将mg CO和H2的混合气体在足量氧气中完全燃烧,再将燃烧后的气体用足量Na2O2充分吸收,Na2O2增重mg | |
| D. | 将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL浓度为0.50 mol/L的HCl溶液中和,则该生成物的成分是Na2O和Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{a}^{b}$R | B. | ${\;}_{a-2}^{a+b-2}$R | C. | ${\;}_{a+2}^{a+b+2}$R | D. | ${\;}_{a-2}^{a+b}$R |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
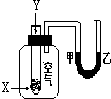 某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到U型管中液面甲处降乙处升.关于该反应的下列叙述:①该反应为放热反应;②生成物的总能量比反应物更高;③该反应过程可以看成是“贮存”于X、Y内部的能量部分转化为热量而释放出来.其中正确的是( )
某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到U型管中液面甲处降乙处升.关于该反应的下列叙述:①该反应为放热反应;②生成物的总能量比反应物更高;③该反应过程可以看成是“贮存”于X、Y内部的能量部分转化为热量而释放出来.其中正确的是( )| A. | ①②③ | B. | ①③ | C. | ①② | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
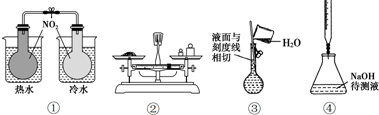
| A. | ①验证温度对平衡移动的影响 | B. | ②称量5.120gNaCl固体 | ||
| C. | ③配制一定物质的量浓度NaCl溶液 | D. | ④中和滴定 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
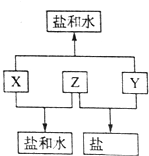 已知:A、B、C、D四种短周期元素,A与D原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,已知Z是常见的两性氢氧化物,试推断回答下列问题.
已知:A、B、C、D四种短周期元素,A与D原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,已知Z是常见的两性氢氧化物,试推断回答下列问题.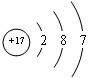 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com