
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652 kJ的热量。
(1)该反应的热化学方程式为____________________________________________。
(2)又知H2O(l)===H2O(g) ΔH=+44 kJ·mol-1,则16 g液态肼与液态双氧水反应生成液态水时放出的热量是________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大的优点是________。
科目:高中化学 来源: 题型:
粗制的CuSO4·5H2O晶体中含有Fe2+。提纯时,为了除去Fe2+,常加入少量H2O2,然后再加入少量碱至溶液pH=4,可以达到除去铁离子而不损失硫酸铜的目的。下列说法不正确的是( )
A.溶解CuSO4·5H2O晶体时要加入少量稀H2SO4
B.加入H2O2,将Fe2+氧化,2Fe2++H2O2+2H+===2Fe3++2H2O
C.由于CuSO4的催化作用,会使部分H2O2分解而损失
D.调溶液 pH=4的依据是Cu(OH)2比Fe(OH)3更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期律和元素周期表是学习化学的重要工具,下列说法不正确的是:
A.同周期的主族元素中,第ⅦA族元素的原子半径最小
B.元素周期表中从第ⅢB族到第ⅡB族十个纵列的元素都是金属元素
C.第ⅥA族元素的原子,其半径越大,气态氢化物越稳定
D.室温下,0族元素的单质都是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13,X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍。下列说法正确的是( )
A.X的氢化物溶于水显酸性且稳定性弱于HF
B.Y的氧化物是离子化合物,Y的氢氧化物碱性比氢氧化钠弱
C.Z的氢化物的水溶液在空气中存放不易变质
D.X和Z的最高价氧化物对应的水化物都是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语使用正确的是 ( )
A.硫原子的原子结构示意图: B.NH4Cl的电子式:
B.NH4Cl的电子式: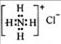
C.N2的结构式::N≡N: D.原子核内有10个中子的氧原子: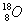
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的每种物质内既有离子键又有共价键的一组是 ( )
A.NaOH、K2SO4、(NH4)2SO4 B.HCl、Al2O3、MgCl2
C.Na2O2、NH4Cl、Na2SO4 D.MgO、Na2SO4、NH4HCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
用O2将HCl转化为Cl2,可提高效益,减少污染,
(1)传统上该转化通过如右图所示的催化剂循环实现,

其中,反应①为:2HCl(g) + CuO(s) 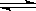 H2O(g)+CuCl2(g) △H1
H2O(g)+CuCl2(g) △H1
反应②生成1molCl2 (g)的反应热为△H2,则总反应的热化学方程式
(g)的反应热为△H2,则总反应的热化学方程式
为 , (反应热用△H1和△H2表示)。
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性,
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的ɑHCl—T曲线如图12,
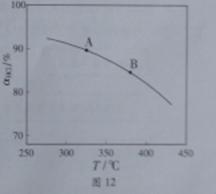
则总反应的△H 0 ,(填“>”、“﹦”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是 。
②在上述实验中若压缩体积使压强增大,画出相应ɑHCl—T曲线的示意图,并简要说明理由: 。
③下列措施中有利于提高ɑHCl的有 。
 A、增大n(HCl) B、增大n(O2)
A、增大n(HCl) B、增大n(O2)
C、 使用更好的催化剂 D、移去H2O
使用更好的催化剂 D、移去H2O
(3)一定条件下测得反应过程中n(Cl 2)的数据如下:
2)的数据如下:
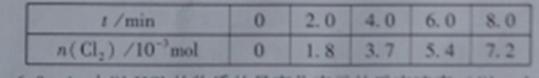
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率(以mol·min-1为单位,写出计算过程)。
(4)Cl2用途 广泛,写出用Cl2制备漂白粉的化学方程式。
广泛,写出用Cl2制备漂白粉的化学方程式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com