
| A. | 纯碱、烧碱均属碱 | B. | SiO2、CO2均属于酸性氧化物 | ||
| C. | 凡能电离出H+的化合物均属酸 | D. | 非金属氧化物一定是酸性氧化物 |
分析 A.水溶液中电离出的阴离子全部是氢氧根离子的化合物为碱,纯碱是碳酸钠;
B.和碱反应生成盐和水的氧化物为酸性氧化物;
C.水溶液中电离出的阳离子全部是氢离子的化合物为酸;
D.和碱反应生成盐和水的氧化物为酸性氧化物,非金属氧化物可以是不成盐氧化物;
解答 解:A.纯碱是碳酸钠属于盐、烧碱是氢氧化钠属于碱,故A错误;
B.SiO2、CO2和碱反应生成盐和水均属于酸性氧化物,故B正确;
C.凡能电离出H+的化合物不一定是酸,如NaHSO4电离出氢离子属于盐,故C错误;
D.非金属氧化物不一定是酸性氧化物,如CO、NO、H2O属于不成盐氧化物,故D错误;
故选B.
点评 本题考查了物质组成、物质分类、物质名称等知识点,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 第2周期 | ① | ② | ||||||
| 第3周期 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 第4周期 | ⑨ | ⑩ |
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:推断题
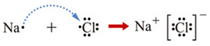
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
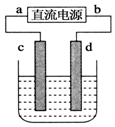 如图,电解质溶液是NaCl的水溶液,过一段时间发现d极附近有黄绿色气体产生,(c、d均为石墨电极)以下说法正确的是( )
如图,电解质溶液是NaCl的水溶液,过一段时间发现d极附近有黄绿色气体产生,(c、d均为石墨电极)以下说法正确的是( )| A. | a是电源的正极 | B. | 电子流动的方向:d→b | ||
| C. | c极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼烧,看火焰是否为黄色 | B. | 滴加盐酸,看是否有气体产生 | ||
| C. | 溶解后测定溶液是否为碱性 | D. | 加热,看是否有气体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 混合溶液的pH |
| I | 0.2 | 0.2 | pH=a |
| II | c1 | 0.2 | pH=7 |
| III | 0.2 | 0.1 | pH>7 |
| IV | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com