

| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、产物B的状态一定为气态 |
| B、平衡时,单位时间内消耗n(A)与消耗n(C)相等 |
| C、保持体积不变,向平衡体系中加入B平衡向逆反应方向移动 |
| D、若开始时向容器中加入1molB和1molC,达到平衡时放出热量QkJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X和Y两种元素构成一种阴离子,该阴离子与强酸反应时,可能变成Y的阳离子 |
| B、元素Y的最高价氧化物能溶于Z的最高价氧化物的水化物中 |
| C、X、Y和Z三元素组成的化合物为碱 |
| D、X与Z的单质在不同条件下能生成不同的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 颜色、性质 | 物质 | 颜色、性质 | |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 | |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 溶液绿色,稀溶液蓝色 | |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
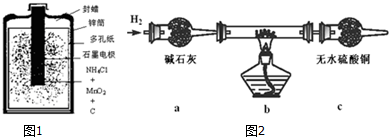
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入0.01 mol?L-1的CH3COOH溶液 |
| B、加入CH3COONa固体 |
| C、稀释 |
| D、加入浓盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com