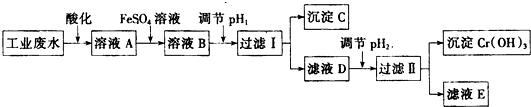
8.某研究性学习小组欲探究FeSO
4•7H
2O(绿矾)的主要化学性质和用途.
I.FeSO
4•7H
2O (绿矾)广泛用于医药和工业领域,以下是FeSO
4•7H
2O的实验室制备流程图:

根据题意回答下列问题:
(1)碳酸钠溶液能除去脂类油污是因为碳酸根水解呈碱性,在碱性条件下油脂会水解生成易溶于水的物质而被除去(用必要的文字说明);
(2)废铁屑中含有少量的Fe
2O
3,在制备过程中无需除去,理由是氧化铁和酸反应生成铁盐,Fe
2O
3+6H
+═2Fe
3++3H
2O,铁盐能被Fe还原生成亚铁盐2Fe
3++Fe═3Fe
2+(用必要的离子方程式说明).
Ⅱ.为测定某补血剂(有效成分为FeSO
4•7H
2O)中铁元素含量,设计实验流程如下,回答下列问题:

(1)步骤①需要用浓硫酸(质量分数为98.3%)配制100mL 1mol•L
-1的稀硫酸,所用的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管及100mL容量瓶;
(2)步骤③所表示的一系列操作依次是:
a.过滤b.洗涤c.灼烧(加热)d.冷却 e.称量 f.重复c~e直至固体质量不变,操作f的目的是确保氢氧化铁完全分解成了氧化铁;
(3)假设实验过程中铁元素无损耗,则每片补血剂含铁元素为0.07ag(用含n的代数式表示).
Ⅲ.利用下图装置探究绿矾的热稳定性

(1)实验过程中,观察到③中品红溶液褪色,据此推测FeSO
4分解过程中最有可能被氧化的元素是Fe,请写出④中反应的离子方程式:2OH
-+SO
2=SO
32-+H
2O或OH
-+SO
2=HSO
3-;
(2)②中有白色沉淀生成,小组成员经过理论分析并结合(1)中的表述推测,绿矾分解的 产物最有可能是下列各项中的b(填序号字母).
a.Fe
2O
3、SO
3、H
2O b.Fe
2O
3、SO
2、SO
3、H
2O c.FeO、SO
2、SO
3、H
2O.





 .用电子式表示F元素与J元素形成化合物的过程
.用电子式表示F元素与J元素形成化合物的过程