
【题目】将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L.请回答:
(1)NO的体积,NO2的体积?
(2)待产生的气体全部释放后,向溶液加入VmL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,求原硝酸溶液的浓度?
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3 , 至少需要30%的双氧水多少克?
【答案】
(1)解:32.64g铜的物质的量为 ![]() =0.51mol,在反应中失去的电子的物质的量为2×0.51mol=1.02mol,11.2L混合气体的物质的量为
=0.51mol,在反应中失去的电子的物质的量为2×0.51mol=1.02mol,11.2L混合气体的物质的量为 ![]() =0.5mol,令NO和NO2的物质的量分别为xmol、ymol,则:
=0.5mol,令NO和NO2的物质的量分别为xmol、ymol,则: ![]() ,
,
解得x=0.26、y=0.24,
NO的体积=0.26mol×22.4L/mol=5.824L
NO2的体积=0.24mol×22.4L/mol=5.376L
答:NO的体积为5.824L,NO2的体积为5.376L
(2)解:将铜离子完全转化为硝酸钠时,根据钠原子守恒得n(NaOH)=n(NaNO3)=0.001aVmol,根据硝酸根离子守恒得起酸作用的硝酸的物质的量=0.001aVmol,根据N原子守恒作氧化剂的硝酸的物质的量=0.5mol,所以硝酸的物质的量浓度= ![]() =
= ![]() mol/L,
mol/L,
答:原硝酸溶液的浓度 ![]() mol/L
mol/L
(3)解:设需要30%的双氧水mg,根据电子得失守恒,有:0.26×3+0.24×1=0.51×2=30%× ![]() ×2,解得:m=57.8,答:需要30%的双氧水57.8克
×2,解得:m=57.8,答:需要30%的双氧水57.8克
【解析】(1)令NO和NO2的物质的量分别为xmol、ymol,根据二者体积及电子转移守恒列方程计算,再根据V=nVm计算各自体积;(1)n(Cu)= ![]() =0.51mol,氮氧化物的物质的量=
=0.51mol,氮氧化物的物质的量= ![]() =0.5mol,根据得失电子守恒计算二者的物质的量,再根据M=
=0.5mol,根据得失电子守恒计算二者的物质的量,再根据M= ![]() 计算其平均摩尔质量;(2)根据N原子守恒计算作氧化剂的硝酸的物质的量,根据硝酸钠的化学式计算起酸作用的硝酸,再根据物质的量浓度公式计算硝酸的物质的量浓度;(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3 , 结合(1)根据得失电子守恒分析,或者硝酸钠中的氮是+5价,所以铜失电子全部给铜来求解.
计算其平均摩尔质量;(2)根据N原子守恒计算作氧化剂的硝酸的物质的量,根据硝酸钠的化学式计算起酸作用的硝酸,再根据物质的量浓度公式计算硝酸的物质的量浓度;(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3 , 结合(1)根据得失电子守恒分析,或者硝酸钠中的氮是+5价,所以铜失电子全部给铜来求解.


科目:高中化学 来源: 题型:
【题目】1mol某烃最多能和2molHCl发生加成反应,生成1mol氯代烷, 1mol此氯代烷能和8molCl 2 发生取代反应,生成只含碳元素和氯元素的氯代烷,该烃可能是( )
A. CH3CH=CHCH2CH3 B. CH2 =CHCH=CH2 C. CH3CH=CHCH3 D. CH3 CH=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境污染已成为人类社会面临的重大威胁,下列对应关系不正确的是( )
A. 酸雨——二氧化硫 B. 温室效应——二氧化碳
C. 光化学烟雾——二氧化氮 D. 白色污染——二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。在空气酸度不大的环境中,其正极反应式为 _________________________________。
(Ⅱ)下列各情况,在其中Fe片腐蚀由快到慢的顺序是(用序号表示)_________________
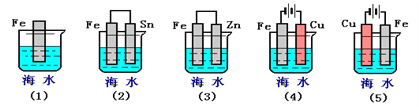
(Ⅲ)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图。请回答:
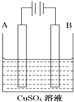
①A电极对应的金属是________(写元素名称),
B电极的电极反应式是_______________________。
②镀层破损后,镀铜铁比镀锌铁更_______被腐蚀(填“容易”“不容易”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】布洛芬常来减轻感冒症状,其结构简式如图,下列有关说法正确的是( )
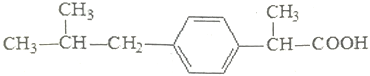
A. 布洛芬的分子式为C13H17O2 B. 布洛芬在核磁共振氢谱中呈现出10种峰
C. 布洛芬与苯乙酸是同系物 D. 布洛芬在苯环上发生取代反应,其一氯代物存4种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com