
| HCl |
| X |
| A、NH3?H2O |
| B、CO2 |
| C、NaOH |
| D、HCl |
 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
| A、NaHCO3═Na++H++CO32- |
| B、NaHSO4═Na++H++SO42- |
| C、H2SO4═2H++SO4- |
| D、KClO3═K++Cl-+3O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、I-、ClO-、H+、Na+ |
| B、K+、HCO3-、OH-、NH4+ |
| C、Fe3+、Cu2+、SO42-、Cl- |
| D、Ca2+、Na+、SO42-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶解 |
| ① |
| BaCl2 |
| ② |
| NaOH |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、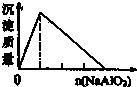 盐酸中加入NaAlO2溶液 |
B、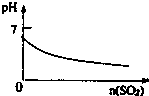 SO2气体通入溴水中 |
C、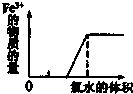 在FeBr2溶液中滴加氯水 |
D、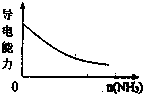 氨气通入醋酸溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
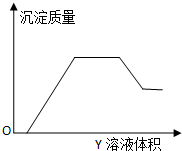 向X溶液中缓慢滴加Y溶液,生成沉淀的质量如图所示,表中符合图象的一组是( )
向X溶液中缓慢滴加Y溶液,生成沉淀的质量如图所示,表中符合图象的一组是( )| X | Y | |
| A | AlCl3、Mg(NO3)2、HNO3 | NaOH |
| B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 |
| C | NH4NO3、Al(NO3)3、Fe(NO3)3、HCl | NaOH |
| D | NaAlO2、氨水、NaOH | H2SO4 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
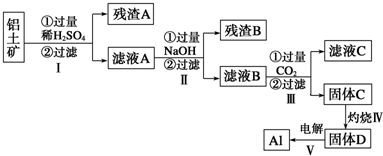
- 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=0的溶液中:Fe3+、Mg2+、Cl-、SO42- |
| B、水电离出的c(H+)=1×10-10的溶液中:K+、HCO3-、Na+、S2- |
| C、使pH试纸显深蓝色的溶液中:Cu2+、Fe3+、NO3-、SO42- |
| D、能与金属铝反应放出氢气的溶液:Mg2+、SO42-、NO3-、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com