
| A. | 甲烷分子的比例模型是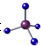 | B. | 二氧化碳的电子式: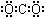 | ||
| C. | HClO的结构式为H-O-Cl | D. | 中子数为17的氯原子:${\;}_{17}^{37}$Cl |
分析 A、甲烷为正四面体结构,分子中存在1个C、4个H原子,且碳原子半径大于氢原子;
B、二氧化碳分子中存在碳氧双键;
C、HClO为O分别为H和Cl形成1对共价键;
D、Cl原子质子数为17,质量数=质子数+中子数.
解答 解:A、甲烷中含有1个C、4个H原子,C原子半径大于氢原子,为正四面体结构,甲烷分子的比例模型为: ,故A错误;
,故A错误;
B、二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为: ,故B错误;
,故B错误;
C、HClO为O分别为H和Cl形成1对共价键,结构式为H-O-Cl,故C正确;
D、Cl原子质子数为17,中子数为17的氯原子,质量数=17+17=34,应为:原子:${\;}_{17}^{34}$Cl,故D错误;故选C.
点评 本题考查了常见化学用语的书写判断,题目难度中等,注意掌握原子结构示意图、比例模型、结构简式、电子式等化学用语的概念及表示方法,选项C为易错点.


科目:高中化学 来源: 题型:解答题
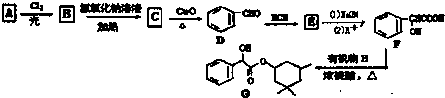
 ,D→E的反应类型为加成反应
,D→E的反应类型为加成反应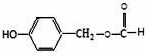
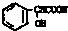 在一定条件下可以合成一种含三个六元环的有机物(C16H12O4),写出该反应的化学方程式
在一定条件下可以合成一种含三个六元环的有机物(C16H12O4),写出该反应的化学方程式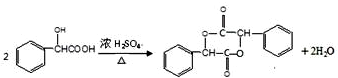
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解法精炼铜,当阴极质量增加32 g时,一定有6.02×1023个电子转移 | |
| B. | 含10.6 g Na2CO3的溶液中,所含阴离子总数等于6.02×1022 | |
| C. | 28 g由乙烯和氮气组成的混合气体中,含有6.02×1023个原子 | |
| D. | 含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为6.02×1022 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 海洋是巨大的资源宝库,具有美好的前景.
海洋是巨大的资源宝库,具有美好的前景. 所示.
所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 双氰胺结构简式如图.
双氰胺结构简式如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 收集到的V L气体都是NO | |
| B. | 过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒 | |
| C. | 操作Ⅱ应是洗涤 | |
| D. | 根据题中已知条件不能求出合金中铜的质量分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
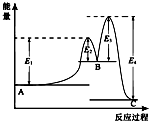 某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )| A. | 两步反应均为吸热反应 | B. | 整个反应中△H=E1+E3-E2-E4 | ||
| C. | 加入催化剂会改变反应的焓变 | D. | 三种化合物中B最稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com