
分析 A管质量增加了2.16g为生成水的质量,B管质量增加了9.24g为生成二氧化碳的质量,根据n=$\frac{m}{M}$计算有机物、水、二氧化碳的物质的量,根据质量守恒计算有机物分子中N(C)、N(H),再根据有机物的相对分子质量计算分子中N(O),据此解答.
解答 解:(1)试管A吸水质量增加2.16g,为生成水的质量,水的物质的量=$\frac{2.16g}{18g/mol}$=0.12mol,含H 0.24mol,氢元素的质量为0.24g,
碱石灰吸CO2增加9.24g,即生成二氧化碳的物质的量=$\frac{2.94g}{44g/mol}$=0.21mol,碳元素的质量为0.21mol×12=2.52g,氧元素的质量:3.24-0.24-2.52=0.48g,
氧元素的物质的量$\frac{0.48}{16}$mol=0.03mol.
N(C):N(H):N(O)=0.21mol:0.24mol:0.03mol=7:8:1
所以有机物的实验式为:C7H8O;
C7H8O的分子量为108,(C7H8O)n小于200,n=1,
答:实验式为C7H8O;化学式C7H8O.
点评 本题考查有机物分子式的计算,题目难度中等,本题注意根据有机物燃烧产物的质量关系确定有机物的分子式,为解答该题的关键.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:解答题
 如图是八种环状的烃类物质:
如图是八种环状的烃类物质: 1,4-二甲苯、
1,4-二甲苯、 1,3,5-三甲苯.
1,3,5-三甲苯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ | B. | K+、NO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$ | ||
| C. | Na+、K+、SO${\;}_{3}^{2-}$ | D. | Na+、NO${\;}_{3}^{-}$、SO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
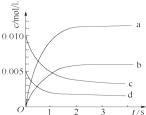 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH可能等于7 | |
| B. | c(HCO3- )=c(CH3COO-) | |
| C. | c(OH-)=$\frac{c(C{H}_{3}COOH)Kw}{c(C{H}_{3}CO{O}^{-})Ka}$ | |
| D. | c(HCO3- )+c(H2CO3)+c(CO3 2-)=c(CH3COOH)+c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com