
【题目】如图是工业电解饱和食盐水的装置示意图,下列说法中不正确的是
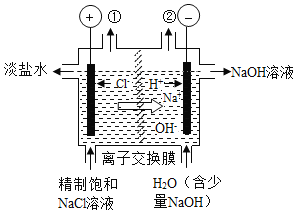
A. 装置出口①处的物质是氯气
B. 出口②处的物质是氢气,该离子交换膜只能让阳离子通过
C. 装置中发生的反应的离子方程式2Cl﹣+2H+![]() Cl2↑+H2↑
Cl2↑+H2↑
D. 该装置是将电能转化为化学能
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D为短周期元素,请根据下表信息回答问题。
元素 | A | B | C | D |
性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物显碱性 | +3价阳离子的核外电子排布与氖原子相同 | 第三周期原子半径最小 |
(1)B在元素周期表的位置:___;B气态氢化物的电子式___。
(2)C的最高价氧化物分别与强酸、强碱反应的离子方程式为___、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 0.1mol/LNaAlO2溶液:![]() 、
、![]() 、
、![]() 、
、![]()
B. pH=11的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
C. 无色溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
D. 使pH试纸变红的溶液中:Fe2+、SO42-、NO3-、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅孔雀石是一种含铜矿石,含铜形态为![]() 和
和![]() ,同时含有
,同时含有![]() 、
、![]() 、
、![]() 、
、![]() 等杂质。以其为原料制取硫酸铜的工艺流程如图:
等杂质。以其为原料制取硫酸铜的工艺流程如图:

(1)将硅孔雀石研磨成粉的目的:__________________;步骤①中稀硫酸与![]() 反应的化学方程式:__________________。
反应的化学方程式:__________________。
(2)双氧水的作用是__________________;滤渣![]() 的主要成分为__________________。
的主要成分为__________________。
(3)步骤②调节溶液![]() ,可以选用的试剂是______。
,可以选用的试剂是______。
A. CuO B. NaOH C.Al2O3 D. Cu(OH)2
(4)有关氢氧化物开始沉淀和完全沉淀的![]() 如下表:
如下表:
氢氧化物 |
|
|
|
|
开始沉淀的 | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的 | 5.2 | 3.7 | 9.7 | 6.7 |
步骤②中,调节![]() ,所得滤渣
,所得滤渣![]() 的成分的化学式为____________,滤液
的成分的化学式为____________,滤液![]() 中除
中除![]() 外,还含有的金属阳离子是______。
外,还含有的金属阳离子是______。
(5)将滤液![]() 通过____________操作可得到五水硫酸铜晶体。测定硫酸铜晶体结晶水的含量时,应将其放入______中灼烧。加热失水后,若在空气中冷却称量,测定结果______(填“偏高”、“偏低”或“不变”)。
通过____________操作可得到五水硫酸铜晶体。测定硫酸铜晶体结晶水的含量时,应将其放入______中灼烧。加热失水后,若在空气中冷却称量,测定结果______(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是

A. 分子组成为Cm(H2O)n的物质一定是糖类
B. 微生物所在电极区放电时发生氧化反应
C. 放电过程中,H+从正极区移向负极区
D. 正极反应式为MnO2+4H++2e-=Mn2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定烧碱纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称取的4.3 g烧碱样品配成250 mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有______________________。
(2)取10.00 mL待测液,用_____________式滴定管量取。
(3)用0.200 0 mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视_____________,直到滴定终点。
(4)根据下列数据,烧碱的纯度为_____________(以百分数表示,小数点后保留两位)。
滴定次数 | 待测体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(5)以标准的盐酸滴定未知浓度的氢氧化钠溶液为例,判断下列操作引起的误差(填“偏大”“偏小”“无影响”或“无法判断”)
①读数:滴定前平视,滴定后俯视_____________;
②用待测液润洗锥形瓶_____________;
③滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下的甲烷和一氧化碳的混合气体8.96 L,其质量是7.60 g,则混合气体中甲烷的体积为________,一氧化碳的质量为_______。
(2)现有CO、CO2的混合气体,根据下列条件回答问题
①若该混合气体在标准状况下的密度为1.79 g/L,则混合气体中CO的体积分数为__________。
②若标准状况下,2.24 L该混合气体的质量为4 g,则混合气体中CO和CO2的物质的量之比为_________。
(3)一定量的甲烷在O2不足的情况下燃烧,得到CO、CO2和H2O的总质量是7.2 g,若其中水的质量为3.6 g,则CO的质量是_________。
(4)在一定条件下,某固体化合物X受热分解方程式为: 2X = A↑+2B↑+3C↑,测得反应后生成的混合气体对H2的相对密度为11。在相同条件下,X的相对分子质量是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液 只含Cl-、![]() 、SO4 2-、Na+、K+、Mg2+六种离子中的某几种。经实验:
、SO4 2-、Na+、K+、Mg2+六种离子中的某几种。经实验:
①原溶液加过量的 NaOH 溶液,产生白色沉淀;
②过滤,取实验①滤液加 BaCl2 溶液不产生沉淀;
③取实验①滤液加稀硝酸酸化,再加 AgNO3 溶液产生白色沉淀, 下列说法不正确的是
A.实验 ① 中的白色沉淀为 Mg(OH)2
B.实验②证明原溶液中一定没有 CO3 2-、SO4 2-
C.原溶液中一定含有的离子是 Cl-、Na+、K+、Mg2+
D.有同学认为原溶液一定有 Cl-,实验③可以省略
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程如下图所示:
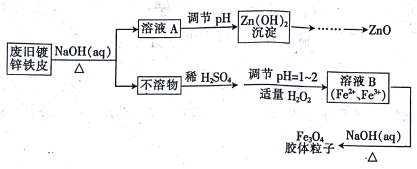
(1)从流程图可知,Zn、Fe中能与NaOH溶液反应的是________。
(2)Zn(OH)2沉淀加热可得ZnO,该反应______(填“是”或“不是”)氧化还原反应。
(3)向不溶物中加入稀H2SO4发生反应的离子方程式是_________。
(4)加入适量H2O2的目的是_________。
(5)如何证明已生成了Fe3O4胶体? _________。
(6)流程中所需的硫酸溶液由焦硫酸(H2SO4·SO3)溶于水配制而成,其中的SO3都转化为硫酸,若将445g焦硫酸溶于水配成4.00L 硫酸,该硫酸的物质的量浓度为__mol/L
(7)稀硫酸也可以用浓硫酸和水配制。已知4mol/L的硫酸溶液密度为ρ1 g/cm3,2mol/L的硫酸溶液密度为ρ2 g/cm3。100g物质的量浓度为4mol/L 的硫酸溶液与___mL水混合,使硫酸的物质的量浓度减小到2mol/L。(用含ρ1、ρ2的式子表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com