
| A. | 铝热法炼铁:Fe2O3+2Al$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+2Fe | |
| B. | 工业上用NH3制备NO:4NH3+5O2$\frac{\underline{\;\;△\;\;}}{\;}$4NO+6H2O | |
| C. | 向受酸雨影响的湖泊中喷洒CaCO3粉末:CO32-+2H+$\frac{\underline{\;催化剂\;}}{\;}$H2O+CO2↑ | |
| D. | 过氧化钠用于呼吸面具中作为氧气的2Na2O2+2CO2═2Na2CO3+O2 |
分析 A.铝热法炼铁原理是铝和氧化铁在高温下发生置换反应;
B.高温、高压、催化剂条件下,氨气被氧化生成NO;
C.在离子反应方程式中,难溶物写化学式;
D.过氧化钠能和二氧化碳反应生成氧气.
解答 解:A.铝热法炼铁原理是铝和氧化铁在高温下发生置换反应,反应方程式为Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,故A正确;
B.高温、高压、催化剂条件下,氨气被氧化生成NO,反应方程式为4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O,故B正确;
C.难溶物写化学式,离子方程式为CaCO3+2H+═H2O+CO2↑+Ca2+,故C错误;
D.过氧化钠能和二氧化碳反应生成氧气,反应方程式为2Na2O2+2CO2═2Na2CO3+O2,故D正确;
故选C.
点评 本题考查了化学反应方程式及离子方程式的书写,明确物质间的反应是解本题关键,知道金属冶炼方法的选取与金属活泼性强弱之间的关系,氨的催化氧化是高考高频点,要熟练掌握元素化合物知识,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙烷含共价键数目为7NA | |
| B. | 25℃时,1.0LpH=13的Ba(OH)2溶液含OH-数目为0.2NA | |
| C. | 铝与氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA | |
| D. | 常温常压下,6gHe含中子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学设计了如图的实验装置来粗略地测定电石中碳化钙的质量分数.
某同学设计了如图的实验装置来粗略地测定电石中碳化钙的质量分数.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
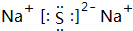 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X、Y处于同一周期,则化合物M不可能是正四面体型分子 | |
| B. | 若X的单质常温下是气体,则Y的单质常温下也是气体 | |
| C. | 若X、Y两元素周期数差1,则属于离子化合物的M只有四种 | |
| D. | 若M属于离子化合物,则其中可能含有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 实验目的 |
| A | 钠和镁分别投入冷水中 | 判断钠和镁金属性强弱 |
| B | 在MgCl2与AlCl3溶液中分别加入过量的氨水 | 判断镁与铝的金属性强弱 |
| C | 向硅酸钠溶液中通入CO2 | 判断碳酸与硅酸的酸性强弱 |
| D | Br2与I2分别与足量的H2反应 | 判断溴与碘的非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ( CH3)2CHCH2CH2CH3 | B. | (CH3CH2)2CHCH3 | C. | (CH3)2CHCH(CH3)2 | D. | (CH3)3CCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;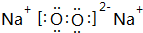 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com