
【题目】明矾[KAl(SO4)212H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料—铝灰(含 Al、Al2O3 及少量 SiO2 和 FeOxFe2O3)可制备明矾。工艺流程如下:

回答下列问题:
(1)欲配制 480 ml 1.0 mol / L H2SO4 溶液,需要 18 mol / L H2SO4 溶液的体积是 __,已有下列仪器:烧杯,量筒,胶头滴管,玻璃棒,还需用到的仪器是 ______。
(2)明矾净水的原理是 ________(用离子方程式表示)。
(3)检验滤液 A 中是否存在 Fe2+ 的实验操作是 ________。
(4)在滤液 A 中加入高锰酸钾溶液的目的是 ______(用离子方程式表示)(该条件下 MnO4- 转化为 Mn2+)
(5)已知:加入 MnSO4,Mn2+ 可与 MnO4- 反应生成 MnO2,该反应氧化剂与还原剂的物质的量之比为 ____。
(6)操作Ⅱ是 _____、______、过滤、洗涤、干燥。
【答案】27.8mL 500mL容量瓶 Al3++3H2O![]() Al(OH)3(胶体)+3H+ 取滤液少许于试管中,滴加铁氰化钾溶液,如果产生蓝色沉淀则有Fe2+ (或滴加酸性高锰酸钾溶液,酸性高锰酸钾溶液褪色则有Fe2+) 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 2:3 蒸发浓缩 冷却结晶
Al(OH)3(胶体)+3H+ 取滤液少许于试管中,滴加铁氰化钾溶液,如果产生蓝色沉淀则有Fe2+ (或滴加酸性高锰酸钾溶液,酸性高锰酸钾溶液褪色则有Fe2+) 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 2:3 蒸发浓缩 冷却结晶
【解析】
铝灰(含Al、Al2O3及少量SiO2和FeOxFe2O3),加入过量稀硫酸酸溶过滤,滤液为硫酸铝、硫酸亚铁、硫酸铁,滤渣Ⅰ为二氧化硅和不溶性杂质,滤液A中加入稍过量高锰酸钾溶液氧化亚铁离子为铁离子,调节溶液PH使铁离子全部沉淀,铝离子不沉淀,加入适量硫酸锰除去过量的高锰酸钾过滤得到二氧化锰固体和氢氧化铁沉淀,滤液主要是硫酸铝溶液,加入硫酸钾蒸发浓缩,冷却结晶过滤洗涤得到硫酸铝钾晶体。
(1)欲配制 480 mL1.0 mol / L H2SO4 溶液,选用500 mL的容量瓶,设需要浓硫酸的体积是V mL,根据稀释前后硫酸物质的量不变,V mL×18 mol / L=500 mL×1 mol / L,V= 27.8mL;用量筒量取27.8mL浓硫酸,沿烧杯内壁缓慢倒入含有适量蒸馏水的烧杯中,并用玻璃棒搅拌,冷却到室温,用玻璃棒引流移入500 mL容量瓶,向容量瓶中倒入蒸馏水,至液面离刻度线1~2cm,改用胶头滴管滴加蒸馏水,至凹液面最低处与刻度线相切,并摇匀。所以需要烧杯,量筒,胶头滴管,玻璃棒,500mL容量瓶。
(2)明矾中铝离子水解生成氢氧化铝胶体,吸附水中的悬浮物,反应的离子方程式是Al3++3H2O![]() Al(OH)3(胶体)+3H+;
Al(OH)3(胶体)+3H+;
(3)Fe2+与铁氰化钾溶液反应生成蓝色沉淀,所以检验Fe2+ 的实验操作是:取滤液少许于试管中,滴加铁氰化钾溶液,如果产生蓝色沉淀则有Fe2+(或滴加酸性高锰酸钾溶液,酸性高锰酸钾溶液褪色则有Fe2+);
(4)高锰酸钾溶液具有氧化性,把Fe2+氧化为Fe3+,反应的离子方程式是5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
(5)加入MnSO4,Mn2+ 可与 MnO4- 反应生成 MnO2,MnSO4中锰元素的化合价由+2升高为+4,MnO4-中锰元素的化合价由+7降低为+4,所以氧化剂MnO4-与还原剂MnSO4的物质的量之比为2:3;
(6)硫酸铝钾溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到硫酸铝钾晶体。


科目:高中化学 来源: 题型:
【题目】分子式为C9H18O2的有机物A有下列转化关系
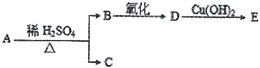
其中B、C的相对分子质量相等,则A的可能结构有
A. 16种 B. 10种 C. 8种 D. 6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是药物中间体,其部分合成路线如下:

已知:RCHO+CH3COR1![]() RCH=CHOR1+H2O
RCH=CHOR1+H2O
请回答下列问题:
⑴D所含官能团有醚键、羟基和________。试剂E的名称是________。
⑵C→D的反应类型为________。G的分子式为________。
⑶写出A→B的化学方程式________。
⑷在上述方案中,设计A→B、C→D步骤的目的是________。
⑸芳香族化合物T是D的同分异构体,T同时具备下列条件的结构有________种。
①能发生银镜反应;
②遇FeCl3溶液不发生显色反应,但其在稀硫酸中水解的产物之一遇FeCl3溶液能发生显色反应。其中,在核磁共振氢谱上有4组峰的T的结构简式为________。
⑹以环己醇和 为原料,设计合成
为原料,设计合成 路线
路线![]() 无机试剂自选
无机试剂自选![]() :________。
:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A常用于食品加工和有机合成。以A为原料制备阴离子树脂M和新型聚酯材料N等的合成路线如下∶

已知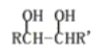
![]()
![]()
⑴A中官能团的结构简式为________;
⑵反应II的反应类型是_______________;
⑶反应H→M的化学方程式是____________________________;
⑷下列关于D的说法正确的是__________;
a.具有还原性 b.不能与H2发生加成反应
c.能与Na单质反应 d.与NaOH醇溶液共热发生消去反应
⑸F的分子式是_____________;
⑹若由B和F只生成1mol 单一聚合度的化合物N的同时生成126g 水,则此时n=__________。
⑺请运用题中已知信息,设计由2-丁烯制备乙醛的合成线路流程图(无机试剂任选)∶____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知在2L的密闭容器中进行如下可逆反应,各物质的有关数据如下:
aA(g) |
| bB(g) |
| 2C(g) | |
起始物质的量浓度/(mol·L-1): | 1.5 | 1 | 0 | ||
2s末物质的量浓度/(mol·L-1): | 0.9 | 0.8 | 0.4 |
请回答下列问题。
①该可逆反应的化学方程式可表示为__。
②用物质B来表示0~2s的平均反应速率为__。
③从反应开始到2s末,A的转化率为__。
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是__(填序号)
A.vB(消耗)=vC(生成)
B.容器内气体的总压强保持不变
C.容器内气体的密度不变
D.vA:vB:vC=3:1:2
E.容器内气体C的物质的量分数保持不变
(2)①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应方程式是2Zn+O2=2ZnO。则该电池的负极材料是__。
②瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池的示意图如图,该燃料电池工作时,电池的总反应方程式为__;负极的电极反应式为__。
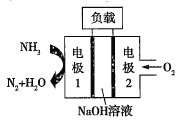
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以磷石膏![]() 主要成分CaSO4,杂质SiO2、Al2O3等
主要成分CaSO4,杂质SiO2、Al2O3等![]() 为原料可制备轻质CaCO3。
为原料可制备轻质CaCO3。

“转化”步骤中浆料清液的pH和c(SO42-)随时间变化如图,下列说法正确的是

A.为提高磷石膏粉的转化率,应通入过量的CO2
B.“转化”步骤,应控制溶液的pH约为7
C.高温煅烧时可发生反应![]() ,从而除去SiO2杂质
,从而除去SiO2杂质
D.向浸取液中通入CO2,可沉淀出几乎所有钙元素,后经过滤、洗涤、烘干即可获得轻质CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) ![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比是1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A. ①②B. ①④C. ②③D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应![]() 在5L的密闭容器中进行,0~30s内,C的物质的量增加了0.30mol。下列叙述正确的是( )
在5L的密闭容器中进行,0~30s内,C的物质的量增加了0.30mol。下列叙述正确的是( )
A.容器中D的物质的量至少为0.45mol
B.0~30s内,A的平均反应速率是0.010 mol·L-1·s-1
C.容器中A、B、C、D的物质的量之比一定是4:5:4:6
D.容器中A的物质的量一定增加了0.30mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醇常用作有机反应的溶剂。实验室制备正丁醚的主要实验装置如图:
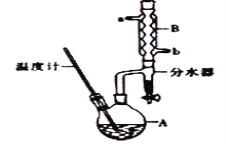
反应物和产物的相关数据如表:
相对分子质量 | 沸点/℃ | 密度(g.cm-3) | 水中溶解性 | |
正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
合成正丁醚的步骤:
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间,分离提纯;
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40mL水、20mLNaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚13g。
请回答:
(1)加热A前,需先从_________(填“a”或“b”)口向B中通入水。
(2)写出步骤②中制备正丁醚的化学方程式____________________________________。
(3)步骤③的目的是初步洗去____________________,振摇后静置,粗产物应从分液漏斗的_____(填“上”或“下”)口分离出。
(4)步骤④中最后一次水洗的目的为_______________________________________。
(5)步骤⑤中,加热蒸馏时应收集________(填选项字母)左右的馏分。
a.100℃b.117℃c.135℃d.142℃
(6)本实验中,正丁醚的产率为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com