
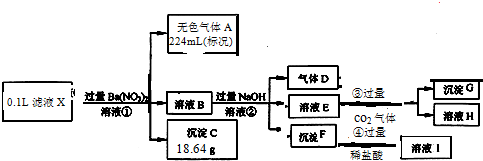
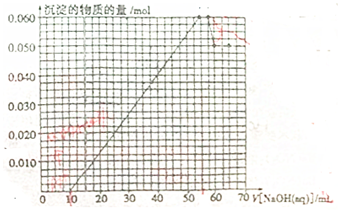
| 原溶液中确定含有的阴离子的化学式 | 该阴离子的物质的量浓度 |
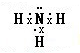 ,故答案为:
,故答案为: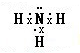 ;
;| 0.224L |
| 22.4L/mol |
| 18.64g |
| 233g/mol |


科目:高中化学 来源: 题型:
| A、取代反应 | B、置换反应 |
| C、氧化反应 | D、加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、等pH的硫酸与醋酸稀释后pH的变化如图所示,则曲线Ⅱ表示的是醋酸的稀释图象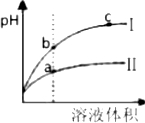 |
| B、容有等物质的量的NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| C、若NH4HCO3溶液、NH4HSO4溶液中c(NH4+)相等,则c(NH4HSO4)<c(NH4HCO3) |
| D、已知某温度下Ksp(CH3COOAg)=2.8×10-3,浓度均为0.1mol?L-1的AgNO3溶液和CH3COONa溶液等体积混合一定能产生CH3COOAg沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3- |
| B、CO32- |
| C、Fe(OH)3 |
| D、CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
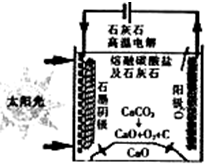 资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡前,随着反应的进行,容器内气体密度逐渐减小 |
| B、平衡时,该反应放出的热量为Q kJ |
| C、平衡后,再向容器中通入1mol 氦气,A的转化率增大 |
| D、平衡后,缩小容器体积,A的浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2具有氧化性,可用于漂白纸浆 |
| B、FeCl3溶液能与Cu反应,可用于蚀刻印刷电路 |
| C、明矾能水解生成Al(OH)3胶体,可用作净水剂 |
| D、Zn具有还原性和导电性,可用作锌锰干电池的负极材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
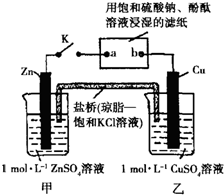
| A、电子沿Zn→a→b→Cu路径流动 |
| B、Cu电极质量增加 |
| C、甲池与乙池中的溶液互换,闭合K,电流没有明显变化 |
| D、片刻后可观察到滤纸b点变红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com