

分析 (1)根据反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”分析,在反应中,Cu被氧化,失电子,应为原电池的负极,电极反应为Cu-2e-=Cu2+,则正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,电解质溶液为AgNO3 ,原电池中,电子从负极经外电路流向正极,由此分析解答;
(2)①若电解质溶液为氯化钠溶液,则乙中为电解氯化钠溶液,阳极氯离子失电子,阴极氢离子得电子;
②根据得失电子数相等确定生成物,再根据反应物和生成物写出反应方程式;
③若乙池的电源连接方向开始时就与上述的图示相反,则Fe为阳极,失去电子,阴极氢离子放电生成氢气和氢氧根离子.
解答 解:(1)①由反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反应中,Cu被氧化,失电子,应为原电池的负极,Ag+在正极上得电子被还原,电解质溶液为AgNO3 ,
故答案为:Cu;AgNO3;
②正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,
故答案为:正; Ag++e=Ag;
③盐桥中装有含琼胶的KNO3 饱和溶液,则盐桥中阳离子向正极移动,K+向AgNO3溶液移动,即向B烧杯中移动,
故答案为:B;
(2)①若电解质溶液为氯化钠溶液,则乙中为电解氯化钠溶液,阳极氯离子失电子,阴极氢离子得电子,则总反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
②过量的Cl2将生成的I2又氧化,氯气被还原生成氯离子,1mol氯气被还原得到2mol电子,若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,根据得失电子数相等知,含碘的酸中碘的化合价是+5价,所以含碘的酸是碘酸,故氯气和碘、水反应生成盐酸和碘酸,反应方程式为:5Cl2+I2+6H2O=2HIO3+10HCl,
故答案为:5Cl2+I2+6H2O=2HIO3+10HCl;
③若乙池的电源连接方向开始时就与上述的图示相反,则Fe为阳极,失去电子,阴极氢离子放电生成氢气,生成的亚铁离子与氢氧根离子反应生成氢氧化亚铁,观察到产生白色沉淀,
故答案为:产生白色沉淀.
点评 本题考查原电池的设计及工作原理、电解原理的应用等,题目难度中等,注意电极反应式的书写方法,牢固掌握原电池中电极的判断,电极反应式的书写的方法等问题.


科目:高中化学 来源: 题型:选择题
| A. | 物质A的转化率增大了 | B. | 平衡向正反应方向移动 | ||
| C. | 物质C的体积分数增大了 | D. | a+b<c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
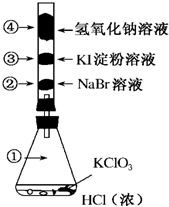 已知常温下氯酸钾与浓盐酸反应放出氯气,现按如图进行氯、溴、碘的性质实验.玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
已知常温下氯酸钾与浓盐酸反应放出氯气,现按如图进行氯、溴、碘的性质实验.玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )| A. | ①黄绿色 ②橙色 ③蓝色 ④白色 | B. | ①无色 ②橙色 ③紫色 ④白色 | ||
| C. | ①黄绿色 ②橙色 ③蓝色 ④无色 | D. | ①黄绿色 ②无色 ③紫色 ④白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔质量 | B. | 密度 | C. | 分子总数 | D. | 质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 工业上用CO和H2生产燃料甲醇.一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态).下列说法错误的是( )
工业上用CO和H2生产燃料甲醇.一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态).下列说法错误的是( )| A. | 反应的化学方程式:CO+2H2?CH3OH | |
| B. | 反应进行至3分钟时,正、逆反应速率相等 | |
| C. | 反应至10分钟,?(CO)=0.075 mol/L•min | |
| D. | 增大压强,平衡正向移动,K增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
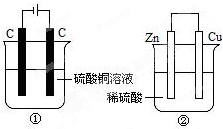 如图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mole-,若不考虑溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mole-,若不考虑溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积①=② | |
| B. | 溶液的pH变化:①减小②增大 | |
| C. | 电极上析出固体质量①<② | |
| D. | 电极反应式:①中阳极:Cu2++2e-═Cu②中负极Zn-2e-═Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混和气为阴极助燃气,制得在650℃下工作的燃料电池,已知其电池反应相当于CO的燃烧,且负极反应式为2CO+2CO32--4e-=4CO2
熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混和气为阴极助燃气,制得在650℃下工作的燃料电池,已知其电池反应相当于CO的燃烧,且负极反应式为2CO+2CO32--4e-=4CO2查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com