
(16分)工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的热值为142.9KJ·g-1
N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)= H2O(l) △H=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为 。
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)  CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是 (填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是 。
a、混合气体的平均式量保持不变
b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
③CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2的浓度随时间的变化。

(2)改变温度,使反应CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应I 恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应II 绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
①达到平衡时,反应I、II对比:平衡常数K(I) K(II)(填“>”、“<”或“=”下同);平衡时CH3OH的浓度c(I) c(II)。
②对反应I,前10min内的平均反应速率v(CH3OH)= ,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1 T2(填“>”、“<”或“=”)。
若30min时只向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡 移动(填“正向”、“逆向”或“不”)。
(16分)Ⅰ. 4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ·mol-1(共3分,方程式2分,但分子式错或无配平或无状态,不给分,数据1分)
Ⅱ.(1)① 低温(1分)
② d e(2分)
③ 图像(共3分)t2起点1分,t3 到t4终点1分,t4以后符合变化趋势即可1分
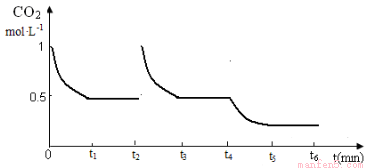
(图中t3 到t4终点平衡线在0.5的线上,偏离大不给分,t4以后在0.5线以下,但不能到横坐标线上且有平衡线段,否则不给分)
(2)① <(1分) <(1分)
② 0.025mol ·L-1·min-1(1分) <(2分) 不(2分)
【解析】
试题分析:I、根据氢气的热值可书写氢气的热化学方程式是2H2(g)+ O2(g)=H2O(l) △H=-142.9×4kJ/mol=-571.6kJ/mol,根据盖斯定律,将已知热化学方程式中的氧气与液态水消去得到H2还原NO2生成水蒸气和氮气的热化学方程式,为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ·mol-1;
II、(1)①该反应的△S<0,所以若反应自发进行,则△H<0,因此反应自发进行的条件是低温自发;
② a、该体系中的气体只有二氧化碳和氢气,且二者的起始物质的量之比等于化学方程式中的化学计量数之比,所以混合气体的平均式量始终不变,不能判断为平衡状态,错误;b、二氧化碳与氢气始终是1:3的关系,所以CO2和H2的体积分数保持不变的状态不是平衡状态,错误;c、二氧化碳与氢气的起始物质的量之比等于化学方程式中的化学计量数之比,所以二者的转化率一定相等,与是否达到平衡状态无关,错误;d 、因为该体系中有液体参加,所以气体的质量在逐渐减少,则气体的密度减小,达平衡时,保持不变,正确;e、1mol CO2生成的同时有3mol H-H键断裂,符合正逆反应速率相等,是平衡状态,答案选de;
③在t2时将容器容积缩小一倍,二氧化碳的浓度瞬间增大到1mol/L,则压强增大,平衡正向移动, t3时达到平衡,达到的平衡与原平衡相同,浓度仍是0.5mol/L;该反应是放热反应,t4时降低温度,则平衡正向移动,t5时达到平衡,则二氧化碳的浓度将小于0.5mol/L,对应的图像见答案。
(2)①因为生成甲醇的反应是放热反应,而反应II是从逆反应开始的,所以反应吸热,所以绝热容器的温度要低于恒温容器,即反应I温度高于反应II,温度升高,放热反应的平衡常数减小,则K(I)<K(II);
二者都是恒容条件,若是恒温恒容,二者达到的平衡是等效平衡,甲醇的浓度相同,而反应I温度高于反应II,所以反应II需再降低温度,而温度降低,平衡正向移动,则甲醇的浓度增大,平衡时CH3OH的浓度c(I)<c(II);
②对反应I,前10min内氢气的物质的量减少6-4.5=1.5mol,则甲醇的物质的量增加0.5mol,所以前10min内平均反应速率v(CH3OH)=0.5mol/2L/10min=0.025mol ·L-1·min-1;
30min时是平衡状态,生成甲醇1mol,则消耗氢气3mol,平衡氢气的物质的量是3mol,而改变温度后氢气的物质的量变为3.2mol,物质的量增大,说明平衡逆向移动,因为该反应是放热反应,所以升高温度,平衡逆向移动,则T1<T2;
若30min时只向容器中再充入1 mol CO2(g)和1 mol H2O(g),根据表中数据计算该温度下的平衡常数为K=1/6.75,此时Qc=1/6.75=K,所以平衡不移动。
考点:考查化学平衡状态的判断,盖斯定律的应用,平衡移动的应用


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015江西省高一上学期期末化学试卷(解析版) 题型:选择题
以下物质间的每步转化通过一步反应能实现的是
A.Al → Al2O3→ Al(OH)3 → NaAlO2
B.Si → SiO2 → H2SiO3 → Na2SiO3
C.N2 → NO→ NO2 → HNO3
D.S → SO3 → H2SO4 → MgSO4
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省高二上学期期末考试化学试卷(解析版) 题型:填空题
(15分)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H)化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C | |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiCl4 SiO2;Si SiC
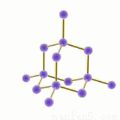
(2)下图每个“●”表示硅晶体中的一个硅原子,每个硅原子与Si—Si键数之比为_____________,属于_________晶体。
(3)工业上所用的高纯硅可以通过下列反应制备得到:SiCl4(g)+2H2(g) =Si(s)+4HCl(g);
根据此方程式并结合上述表格中数据可计算出此反应的△H=+236KJ.mol-1,请判断该反应是 反应(填“吸热”或“放热”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三3月阶段测试理综化学试卷(解析版) 题型:实验题
(16分)铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
Zn2++2Fe2++3C2O42-+6H2O ZnFe2(C2O4)3·6H2O↓…………(a)
ZnFe2(C2O4)3·6H2O↓…………(a)
ZnFe2(C2O4)3·6H2O  ZnFe2O4 + 2CO2↑+4CO↑+6H2O …………(b)
ZnFe2O4 + 2CO2↑+4CO↑+6H2O …………(b)
已知:ZnC2O4和FeC2O4难溶于水。
(1)上述制备原理中不属于氧化还原反应的是 (选填:“a”或“b”)。
(2)制备ZnFe2(C2O4)3·6H2O时,可选用的药品有:
Ⅰ.(NH4)2Fe(SO4)2·6H2O
Ⅱ.ZnSO4·7H2O
Ⅲ.(NH4)2C2O4·7H2O。
①称量药品时,必须严格控制n(Fe2+)/n (Zn2+)= 。
②选用的加料方式是 (填字母)。
a.按一定计量比,Ⅰ、Ⅱ、Ⅲ同时加入反应器并加水搅拌,然后升温至75℃。
b.按一定计量比,Ⅰ、Ⅲ同时加入反应器加水配成溶液,然后加入Ⅱ,再升温到75℃。
c.按一定计量比,将Ⅰ、Ⅱ混合并配成溶液甲,Ⅲ另配成溶液乙,甲、乙同时加热到
75℃,然后将乙溶液缓慢加入甲溶液中,并持续搅拌。
(3)从溶液中分离出ZnFe2(C2O4)3·6H2O需过滤、洗涤。已洗涤完全的依据是 。
(4)ZnFe2(C2O4)3·6H2O热分解需用酒精喷灯,还用到的硅酸盐质仪器有 。
(5)某化学课外小组拟用废旧干电池锌皮(含杂质铁),结合下图信息从提供的试剂中选取适当试剂,制取纯净的ZnSO4·7H2O。

实验步骤如下:
①将锌片完全溶于稍过量的3mol·L-1稀硫酸,加入 (选填字母,下同)。
A.30%H2O2 B.新制氯水 C.FeCl3溶液 D.KSCN溶液
②加入 。
A.纯锌粉 B.纯碳酸钙粉末 C.纯ZnO粉末 D.3mol·L-1稀硫酸
③加热到60℃左右并不断搅拌。
④趁热过滤得ZnSO4溶液,再蒸发浓缩、冷却结晶,过滤、洗涤、干燥。
其中步骤③加热的主要目的是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三3月阶段测试理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.淀粉、纤维素和油脂都属于天然高分子化合物
B.蛋白质溶液中加入硫酸铜溶液,有白色沉淀产生,加水,白色沉淀重新溶解
C.等质量的CH4、C2H4、C2H2分别在氧气中完全燃烧,消耗氧气的量依次减少
D.分子式为C2H4O2与C4H8O2的两种物质一定属于同系物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省温州市高三一模理综化学试卷(解析版) 题型:选择题
某充电宝锂离子电池的总反应为:xLi + Li1-xMn2O4  LiMn2O4,某手机镍氢电池总反应为:NiOOH + MH
LiMn2O4,某手机镍氢电池总反应为:NiOOH + MH M+ Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是:
M+ Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是:

A.锂离子电池放电时Li+向正极迁移
B.镍氢电池放电时,正极的电极反应式:NiOOH+H2O +e-== Ni(OH)2+OH-
C.上图表示用锂离子电池给镍氢电池充电
D.锂离子电池充电时,阴极的电极反应式:LiMn2O4—xe-== Li1-xMn2O4+ xLi+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省大冶市高三上学期期末联考理综化学试卷(解析版) 题型:实验题
利用硫酸工业废渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:

(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,②__________________。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为____________.
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。
实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-===2Fe2++SnCl
Sn2++4Cl-+2HgCl2=== SnCl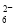 +Hg2Cl2↓
+Hg2Cl2↓
6Fe2++ Cr2O +14H+===6Fe3++2Cr3++7H2O
+14H+===6Fe3++2Cr3++7H2O
①若SnCl2不足量,则测定的Fe3+量__________(填“偏高”、“偏低”、“不变”)。
②若不加HgCl2,则测定的Fe3+量偏高,其原因是_____________。
(4)①可选用______________(填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是_________________(用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的,pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 | Mn(OH)2 |
开始沉淀 | 2.3 | 7.5 | 3.4 | 9.4 | 8.3 |
完全沉淀 | 3.2 | 9.7 | 4.4 | 12.4 | 9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化:__________________________;
b.沉淀:_____________________;
c.分离,洗涤;
d.烘干,研磨。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三下学期第一次月考理科综合化学试卷(解析版) 题型:选择题
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | SO2可使酸性高锰酸钾褪色 | SO2有漂白性 |
B | 浓硫酸具有脱水性和强氧化性 | 浓硫酸滴到湿润的蔗糖中,蔗糖变 成黑色海绵状 |
C | SiO2有导电性 | SiO2可用于制备光导纤维 |
D | BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀 | Ksp(BaSO4)<Ksp(BaCO3) |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三3月教学质量检查理综化学试卷(解析版) 题型:选择题
下列关于有机物的判断错误的是
A.乙烯和苯使溴水褪色的原理不同
B.乙醇、乙酸都能和金属钠反应
C.C2H6O只代表一种物质
D.淀粉和纤维素都可作为工业上生产葡萄糖的原料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com