
| A. | 生成 SO3 为 2 mol | |
| B. | SO2 和 SO3 物质的量之和一定为 3 mol | |
| C. | 1molO2 恰好反应完 | |
| D. | SO2 的物质的量和 SO3 物质的量一定相等 |
分析 A.可逆反应的特点:反应不能进行到底.可逆反应无论进行多长时间,反应物都不可能100%地全部转化为生成物;
B.根据元素守恒进行判断;
C.可逆反应的特点:反应不能进行到底.可逆反应无论进行多长时间,反应物都不可能100%地全部转化为生成物;
D.SO2的物质的量和SO3物质的量的大小关系取决于原始投料量和转化率.
解答 解:A.可逆反应无论进行多长时间,反应物都不可能100%地全部转化为生成物,故生成SO3小于2mol,故A错误;
B.根据S元素守恒可知,S的总的物质的量保持不变,即SO2和SO3物质的量之和一定为3mol,故B正确;
C.可逆反应无论进行多长时间,反应物都不可能100%地全部转化为生成物,故1molO2 不可能反应完,故C错误;
D.SO2的物质的量和SO3物质的量的大小关系取决于原始投料量和转化率,故D错误,
故选B.
点评 本题考查可逆反应的特点,难度不大,要注意可逆反应无论进行多长时间,反应物都不可能100%地全部转化为生成物.


科目:高中化学 来源: 题型:选择题
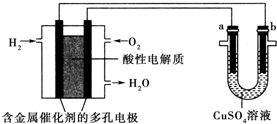
| A. | 燃料电池工作时,正极反应为O2+2H2O+4e-═4OH- | |
| B. | 此装置用于铁表面镀铜时,a为铁 | |
| C. | a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 | |
| D. | a、b两极均是石墨时,在相同条件下,a极产生的气体与电池中消耗的H2体积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含一种分子的物质是纯净物,只含一种元素的物质也是纯净物 | |
| B. | 医疗上的血液透析利用了胶体的性质 | |
| C. | NH3溶于水后所得的溶液可以导电,所以NH3为电解质 | |
| D. | 从海水中可以得到NaCl,电解NaCl溶液可制备Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在外电路中,电子由银电极流向铜电极 | |
| B. | 取出盐桥后,电流计的指针仍发生偏转 | |
| C. | 外电路中每通过0.1 mol电子,铜的质量理论上减小6.4 g | |
| D. | 原电池的总反应式为Cu+2AgNO3=2Ag+Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 既能与酸又能与碱反应的物质一定是两性氧化物或两性氢氧化物 | |
| B. | 往Fe(OH)3胶体中逐滴加入稀H2SO4溶液时,开始时会出现沉淀,再继续滴加时,沉淀又会消失 | |
| C. | 胶体区别于其他分散系的本质特征是丁达尔现象 | |
| D. | 某物质溶于水后所得溶液能导电,该物质一定属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
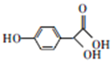
| A. | 用钠可检验M分子中存在羟基 | B. | M能发生酯化、加成、氧化反应 | ||
| C. | M的分子式为C8H8O4 | D. | M的苯环上一硝基代物有2种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com