
分析 (1)pH=a的强酸稀释至原来体积的10b倍,则溶液pH=a+b(a+b<7);
(2)pH=c的强碱稀释至原来体积的10d倍,则溶液pH=c-d(c-d<7);
(3)酸溶液混合,先计算混合后溶液中氢离子的物质的量,再根据c=$\frac{n}{V}$计算氢离子的物质的量浓度,最后根据pH=-lgc(H+)计算出混合液的pH;
(4)先计算混合溶液中氢氧根离子浓度,再根据水的离子积常数计算氢离子浓度,从而得出溶液的pH;
(5)pH=3的盐酸溶液和pH=11的氢氧化钠溶液等体积混合后,两者恰好完全反应;
(6)设所需的盐酸的体积为xL,氢氧化钠的体积为YL,根据混合后溶液pH=9,显碱性,故应根据氢氧根的浓度来计算,
解答 解:(1)pH=a的强酸稀释至原来体积的10b倍,则溶液pH=a+b(a+b<7),故pH=3的盐酸溶液稀释到原来的10倍,pH=4;再稀释100倍,pH=6,
故答案为:4;6;
(2)pH=c的强碱稀释至原来体积的10d倍,则溶液pH=c-d(c-d<7),故pH=11的氢氧化钠溶液稀释到原来的10倍,pH=10;再稀释10倍,pH=9;再稀释100倍,pH=7,故答案为:10;9;7;
(3)pH=1的盐酸和pH=3的硫酸等体积混合后,设体积均为VL,
混合液中氢离子的物质的量为:n(H+)=VL×10-1mol/L+VL×10-3mol/L=0.101Vmol,
则混合溶液中氢离子浓度为:c(H+)=$\frac{0.101Vmol}{2VL}$=5.05×10-2mol/L,
所以pH=-lg5.05×10-2=2-lg5.5=1.3,故答案为:1.3;
(4)pH=9 和pH=11的两种氢氧化钠溶液中氢氧根离子浓度分别是10-5 mol/L、10-3mol/L,二者等体积混合,则混合溶液中氢氧根离子浓度=$\frac{1{0}^{-5}mol/L+1{0}^{-3}mol/L}{2}$=4.95mol/L,则混合溶液中氢离子浓度=$\frac{1{0}^{-14}}{4.95}$=2×10-11 mol/L,则混合溶液的pH=11-0.3=10.7,
故答案为:10.7;
(5)pH=3的盐酸溶液和pH=11的氢氧化钠溶液等体积混合后,两者恰好完全反应,反应后溶液显中性,故pH=7,故答案为:7;
(6)设所需的盐酸的体积为XL,氢氧化钠的体积为YL,由于混合后溶液pH=9,显碱性,根据混合后氢氧根的浓度c(OH-)=10-5mol/L=$\frac{1{0}^{-2}mol/L×YL-1{0}^{-3}mol/L×XL}{XL+YL}$,则可解得:X:Y=999:101,故答案为:999:101.
点评 本题考查强酸和强碱加水稀释、酸酸混合、碱碱混合和酸碱混合的计算,解答本题的关键是把握Kw=c(OH-)×c(H+)的计算,题目难度中等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
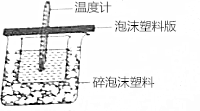 某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.
某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
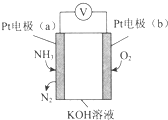
| A. | 溶液中OH-向电极a移动 | |
| B. | O2在电极b上发生还原反应 | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:5 | |
| D. | 电极a的反应式为2NH3-6e-+6OH-═N2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N、O、F元素非金属性依次减弱 | |
| B. | Na、Mg、Al元素最高化合价依次升高 | |
| C. | Na、Li、K原子的电子层数依次增多 | |
| D. | P、Cl、S元素最高价氧化物对应的水化物酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
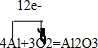 ,红墨水柱右端上升说明这是一个放热反应.
,红墨水柱右端上升说明这是一个放热反应.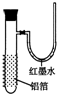
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、K+、S2-、SO42- | B. | Na+、K+、AlO2-、Cl- | ||
| C. | Mg2+、NH4+、Cl-、NO3- | D. | Na+、K+、CO32-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com