
铝士矿(主要成分为![]() 、
、![]() 、
、![]() )是提取氧化铝的原料.提取氧化铝的
)是提取氧化铝的原料.提取氧化铝的
工艺流程如下:
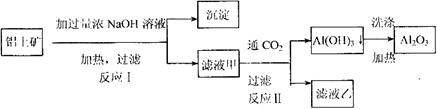
(1)写出反应Ⅱ的离子方程式_________________________________________________
(2)已知滤液乙的成分除![]() 外还含有
外还含有![]() 、
、![]() 中的一种或两种,所含物质的质量分数都在5%以上。请设计合理实验探究该滤液乙中
中的一种或两种,所含物质的质量分数都在5%以上。请设计合理实验探究该滤液乙中![]() 、
、![]() 的存在。仅限选择的仪器和试剂:烧杯、试管、带导管的橡皮塞、玻璃棒、蒸发皿、泥三角、三脚架、铁架台、酒精灯、过滤器、洗气瓶、滴管、药匙;lmol?L
的存在。仅限选择的仪器和试剂:烧杯、试管、带导管的橡皮塞、玻璃棒、蒸发皿、泥三角、三脚架、铁架台、酒精灯、过滤器、洗气瓶、滴管、药匙;lmol?L![]() 盐酸、2mol?L
盐酸、2mol?L![]() MgCl2溶液、澄清饱和石灰水。
MgCl2溶液、澄清饱和石灰水。
完成以下实验探究过程:
①提出假设:
假设1:滤液乙中除![]() 外还含有__________________;
外还含有__________________;
假设2:滤液乙中除![]() 外还含有_________________;
外还含有_________________;
假设3:滤液乙中除![]() 外还含有
外还含有![]() 、
、![]() ;
;
②设计实验方案:基于假设3,设计出实验方案(筒述实验操作、预期现象和结论)。
___________________________________________________________________________
__________________________________________________________________________。
(3)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失。沉淀消失的原因可用离子方程式表示为_____________________________________________________________
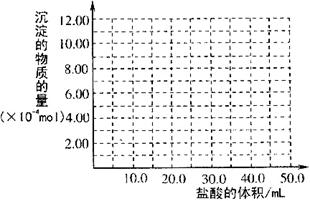 (4)取(3)电解以后的溶液10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol?L
(4)取(3)电解以后的溶液10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol?L![]() 盐酸溶液,当加入50.0mL盐酸溶液时,生成的沉淀恰好溶解。
盐酸溶液,当加入50.0mL盐酸溶液时,生成的沉淀恰好溶解。
①加入50.0mL盐酸溶液发生
的离子反应按先后顺序依次为
__________________________
__________________________。
②请画出生成沉淀的物质的量
与加入盐酸体积的关系图。
科目:高中化学 来源:2011-2012学年四川省乐山市高三第二次调查研究考试理科综合试卷(化学部分) 题型:填空题
(13分)
用菱锌矿(主要成分为碳酸锌,还含有Fe2+、Fe3+、Mg2+、Ca2+、Cu2+等)制备氯化锌的一种流程如下。

(1) 在反应3前要将菱锌矿研磨,其目的是。
(2) 反应4将Fe2+ 氧化为Fe3+,该反应的离子方程式为。
(3) 加入氧化锌调节至pH=4.5,反应5的离子方程式为。
(4) 锌粉不在反应4之前加入的原因是。
(5) 若用石墨做电极电解滤液Y,则可以得到参与本流程反应的物质有。
查看答案和解析>>
科目:高中化学 来源: 题型:
重晶石矿(主要成分为硫酸钡)因为含有Fe2O3、MnO及炭质等杂质而常呈深褐色,工业上将重晶石矿粉碎后与硫酸、铝粉在反应槽中混台加热(即“漂白”),再经水洗等一系列工序制得白色的重晶石填料,广泛用作纸张、油漆等的填充剂。
重晶子填料的生产工艺流程为:
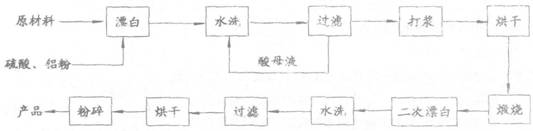
(1)在该流程中,为加快“浮白”速度,可采取的措施有
.
(2)硫酸起到了“漂白”的作用。请写出硫酸直接起到该作用时的化学方程式: 。
(3)铝粉也起到了“漂白”的作用。你认为,铝粉是如何起到该作用的? ;有同学认为,既然两次水洗,那么铝粉的作用就不大。你的解释是: 。
(4)煅烧的主要目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
重晶石矿(主要成分为硫酸钡)因为含有Fe2O3、MnO及炭质等杂质而常呈深褐色。
工业上将重晶石矿粉碎后与硫酸、铝粉在反应槽中混合加热(即“漂白”),再经水洗等一系列工序制得白色的重晶石填料,广泛用作纸张、油漆等的填充剂。已知MnO是碱性氧化物,Al粉可以将深色的Fe3+转化为浅色的Fe2+。
重晶石填料的生产工艺流程为:

(1)在该流程中,为加快“漂白”速度,采取的措施有 、 。
(2)硫酸起到了“漂白”的作用。请写出硫酸直接起到该作用时的化学方程式:
、 。
(3)二次漂白水洗过滤后,检验滤渣不含Fe2+离子的方法是
。
(4)二次漂白前,煅烧的主要目的是 。
(5)将煅烧后的固体磨细,使用的是加有刚玉(氧化铝)球的振动磨。这说明刚玉具有很高的 。
(6)工业生产中为了充分利用资源,将滤液经过处理得到化工原料Fe2O3。操作过程是:
①通入过量氧化剂(Cl2),其目的是 。
②加入适量NaOH来调节溶液的pH ,其目的是 ,
调节溶液的pH范围为 。
有关离子开始沉淀及完全沉淀时的pH如下:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
③最后通过 、 、灼烧得到氧化铁。
查看答案和解析>>
科目:高中化学 来源:2010年上海市卢湾区高考模拟考试 题型:实验题
重晶石矿(主要成分为硫酸钡)因为含有Fe2O3、MnO及炭质等杂质而常呈深褐色。
工业上将重晶石矿粉碎后与硫酸、铝粉在反应槽中混合加热(即“漂白”),再经水洗等一系列工序制得白色的重晶石填料,广泛用作纸张、油漆等的填充剂。已知MnO是碱性氧化物,Al粉可以将深色的Fe3+转化为浅色的Fe2+。
重晶石填料的生产工艺流程为:
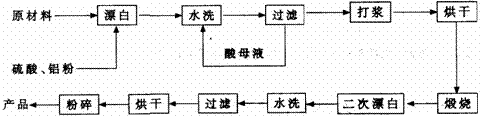
(1)在该流程中,为加快“漂白”速度,采取的措施有 、 。
(2)硫酸起到了“漂白”的作用。请写出硫酸直接起到该作用时的化学方程式:
、 。
(3)二次漂白水洗过滤后,检验滤渣不含Fe2+离子的方法是
。
(4)二次漂白前,煅烧的主要目的是 。
(5)将煅烧后的固体磨细,使用的是加有刚玉(氧化铝)球的振动磨。这说明刚玉具有很高的 。
(6)工业生产中为了充分利用资源,将滤液经过处理得到化工原料Fe2O3。操作过程是:
①通入过量氧化剂(Cl2),其目的是 。
②加入适量NaOH来调节溶液的pH ,其目的是 ,
调节溶液的pH范围为 。
有关离子开始沉淀及完全沉淀时的pH如下:
|
离子 |
开始沉淀时的pH |
完全沉淀时的pH |
|
Fe2+ |
7.6 |
9.7 |
|
Fe3+ |
2.7 |
3.7 |
|
Al3+ |
3.8 |
4.7 |
|
Mn2+ |
8.3 |
9.8 |
③最后通过 、 、灼烧得到氧化铁。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com