

 N2O4�Ѿ��ﵽƽ�⡣
N2O4�Ѿ��ﵽƽ�⡣
 N2O4
N2O4

 Сѧ������ҵϵ�д�
Сѧ������ҵϵ�д� ��ʿһ��ȫͨϵ�д�
��ʿһ��ȫͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 4NO��g����6H2O��g��������˵����ȷ���ǣ� ��
4NO��g����6H2O��g��������˵����ȷ���ǣ� ��| A���ﵽ��ѧƽ��ʱ��4v����O2����5v����NO�� |
| B������λʱ��������xmol NO��ͬʱ����xmol NH3����Ӧ�ﵽƽ��״̬ |
| C���ﵽƽ��״̬ʱ�����������������������Ӧ���ʼ�С���淴Ӧ�������� |
| D����ѧ��Ӧ���ʹ�ϵ�ǣ�2v����NH3����3v����H2O�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C��g��+xD��g��DH��0 ��5min��ƽ�⣬��ʱ����2molC�����D��ƽ����Ӧ����Ϊ0.1mol��(L��min)-1.����˵������ȷ����
2C��g��+xD��g��DH��0 ��5min��ƽ�⣬��ʱ����2molC�����D��ƽ����Ӧ����Ϊ0.1mol��(L��min)-1.����˵������ȷ����| A��B��ת����Ϊ25% |
| B��A��ƽ����Ӧ����Ϊ0.15mol��(L��min)-1 |
| C�������´ﵽƽ��ı�־��C��D������������� |
| D�������¶ȣ��淴Ӧ���ʱ�С������Ӧ��������ƽ�������ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C����������H<0 ���� 2 s���룩���� C ��Ũ��Ϊ0.6 mol��L��1 ���������м���˵����
2C����������H<0 ���� 2 s���룩���� C ��Ũ��Ϊ0.6 mol��L��1 ���������м���˵�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g)(����Ӧ����)������ͼ����ȷ����
2C(g)(����Ӧ����)������ͼ����ȷ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO(g)+3H2 (g)����I CO(g)+2H2(g)
CO(g)+3H2 (g)����I CO(g)+2H2(g)  CH3OH(g) ����II��
CH3OH(g) ����II��
| A�������¶� | B����CH3OH(g)����ϵ�з��� |
| C������He��ʹ��ϵ��ѹǿ���� | D���ٳ���1mol CO��3mol H2 |
| ʵ���� | T(��) | N(CO)/n(H2) | P��Mpa�� |
| i | 150 | 1/3 | 0.1 |
| ii | | | 5 |
| iii | 350 | | 5 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��


 ��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���| t/s | 0 | 50 | 150 | 250 | 350 |
| n��PCl3��/mol | 0 | 0��16 | 0��19 | 0��20 | 0��20 |

 ����Ӧ��
����Ӧ��
 ��
�� ��
��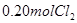 ���ﵽƽ��ǰv������>v���棩
���ﵽƽ��ǰv������>v���棩 ��
��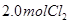 ���ﵽƽ��ʱ��
���ﵽƽ��ʱ�� ��ת����С��80%
��ת����С��80%�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2C(g)���ﵽƽ��������¶�ʱ��A��ת���ʱ�С������Сѹǿʱ�������ϵ��C�������������䣬��:
2C(g)���ﵽƽ��������¶�ʱ��A��ת���ʱ�С������Сѹǿʱ�������ϵ��C�������������䣬��: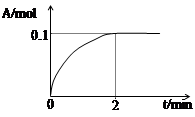
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3(g)��20 min��N2�����ʵ���Ϊ1.9 mol��1 h���������������ѹǿ���ٸı䣬��Ϊ��Ӧ��ʼʱѹǿ��0.8����������������ȷ���ǣ� ��
2NH3(g)��20 min��N2�����ʵ���Ϊ1.9 mol��1 h���������������ѹǿ���ٸı䣬��Ϊ��Ӧ��ʼʱѹǿ��0.8����������������ȷ���ǣ� ��| A��1 h��Ӧ������ȫ�������е�N2Ũ��Ϊ0.55 mol��L��1 |
| B��ǰ20 min��NH3��ʾ�ķ�Ӧ����Ϊ0.01 mol��L��1��min��1 |
| C������H2��Ũ�Ȼ��¶ȣ�ƽ�⽫������Ӧ�����ƶ����ҷ�Ӧ���ʾ��ӿ� |
| D����������ѹǿ���ı�ʱ��˵����Ӧ�Ѵﵽƽ��״̬ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com