
A.液溴易挥发,在存放液溴的试剂瓶中应加水封
B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示:

请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是__________________________________、
___________________________________________________________________________;
(2)基态B___________________________________________________________________;
B和N相比,电负性较大的是________,BN中B元素的化合价为________;
(3)在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF 的立体构型为____________;
的立体构型为____________;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间化学键为____________,层间作用力为___________________________________________________________________;
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼晶胞中含有________个氮原子、________个硼原子,立方氮化硼的密度是________ g·cm-3(只要求列算式,不必计算出数值。阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了除去氯化钠样品中的杂质碳酸钠,某兴趣小组最初设计了如下方案并进行了实验。

(1)写出沉淀A的化学式___________________________;
(2)加入过量氯化钙溶液后,分离除去沉淀A的实验操作方法是____________________
_______________________________________________________________________。
(3)他们在实验过程中,又发现了新的问题:此方案很容易引入新的杂质,请写出固体物质B的成分________(用化学式表示);
(4)他们继续探究后又提出了新的方案:将混合物溶解,滴加盐酸至不再产生气体为止,既能除去碳酸钠杂质,又能有效地防止新杂质的引入。有关反应的化学方程式为
___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
乙酸香兰酯是用于调配奶油、冰淇淋的食用香精,其合成反应的化学方程式如下:

下列叙述正确的是( )
A.该反应属于取代反应
B.乙酸香兰酯的分子式为C10H8O4
C.FeCl3溶液可用于区别香兰素与乙酸香兰酯
D.乙酸香兰酯在足量NaOH溶液中水解得到乙酸和香兰素
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.01 mol下列物质分别加入100 mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)( )
①Na2O2 ②Na2O ③Na2CO3 ④NaCl
A.①>②>③>④ B.①>②>④>③
C.①=②>③>④ D.①=②>③=④
查看答案和解析>>
科目:高中化学 来源: 题型:
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
①下列收集Cl2的正确装置是________。

②将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是________。
③设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,____________________________________________________________________________。
(2)能量之间可相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。

①完成原电池甲的装置示意图(见图),并作相应标注。
要求:在同一烧杯中,电极与溶液含相同的金属元素。
②铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极________。
③甲乙两种原电池中可更有效地将化学能转化为电能的是________,其原因是________________________________________________________________________
________________________。
(3)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(2)的材料中应选________作阳极。
查看答案和解析>>
科目:高中化学 来源: 题型:
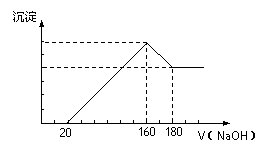 将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如 图。(横坐标体积单位是mL,纵坐标质量单位是 g)求:
将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如 图。(横坐标体积单位是mL,纵坐标质量单位是 g)求:
(1)加入NaOH溶液0--20mL过程中反应方程式
为:_______________________。160--180mL过程中反应方程式为_______________________。
(2)合金中Mg的质量为____________g。所用HCl 的物质的量浓度为____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)α氨基酸能与HNO2反应得到α羟基酸。如:

试写出下列变化中A、B、C、D四种有机物的结构简式:
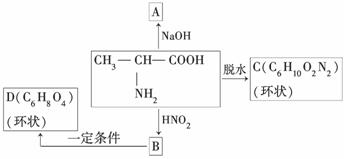
A________________、B______________、
C________________、D__________________。
(2)下列物质中,既能与NaOH反应,又能与硝酸反应,还能水解的是________。
①Al2O3 ②Al(OH)3 ③氨基酸 ④二肽
⑤ ⑥(NH4)2CO3 ⑦NaHCO3
⑥(NH4)2CO3 ⑦NaHCO3
⑧纤维素 ⑨蛋白质 ⑩NH4I
A.①②③④ B.④⑤⑥⑦⑨⑩
C.③④⑤⑥⑧⑨ D.全部
(3)下列有关蛋白质的叙述中正确的是________。
①蛋白质溶液里加入饱和硫酸铵溶液,有沉淀析出,再加入水,也不溶解;
②温度越高,酶催化的化学反应越快;
③天然蛋白质的水解最终产物均为α氨基酸;
④重金属盐能使蛋白质变性,所以误食重金属盐会中毒;
⑤氨基酸和蛋白质均是既能与酸反应又能与碱反应的两性物质;
⑥通常用酒精消毒是因为酒精能使细菌中的蛋白质变性而失去生理活性;
⑦鉴别织物是蚕丝还是人造丝,可用灼烧闻气味的方法。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com