
����Ŀ����ѧ����ԭ�ӡ����ӵIJ������о����ʵ���ɡ��ṹ�����ʼ��仯���ɵĿ�ѧ������ˮΪ��������ѧ��֪ʶ�ش��������⣮
��1������ˮ�����ӿɱ�ʾΪ������ţ���
��2���Ӻ���Ͽ���ˮ����Ԫ����ɣ�
��3����ˮ�����������У�����˵����ȷ����������ţ���
A.ˮ����֮��������
B.ˮ�����ڲ����˶�
C.�Ƿ��ӷֽ����ԭ�Ӻ���ԭ��
D.ˮ���ӱ����
��4��ˮ�dz��õ��ܼ������������ʼ���ˮ�У���ֽ��裬�����γ���Һ����������ţ���
A.�ƾ�
B.����
C.������
D.�������
��5����Ȼˮ��ΪӲˮ�������п�ͨ������ʹ������������Ӳˮ����ˮ�ķ����ɼ������м���
��6������ˮ��������ϧˮ��Դ����ÿ������Ӧ�������κ��������������������ˮ����Ⱦ����������ţ���
A.����ʹ��ũҩ����
B.���Ͼɵ������������
C.������ֳ����ˮֱ�����뽭����
D.��ˮ��Դ��������ֲ������
��7��д��������ˮ�йصĻ�ѧ��Ӧ����ʽ��ˮͨ��ֽ���
��ˮ����ʯ�ҷ�Ӧ��ȡ��ʯ�� ��
���𰸡�
��1��A
��2����Ԫ�غ���Ԫ��
��3��B
��4��C
��5��������У�����ˮ
��6��D
��7��2H2O ![]() 2H2��+O2����CaO+H2O=Ca��OH��2
2H2��+O2����CaO+H2O=Ca��OH��2
���������⣺��1��ÿ��ˮ������2����ԭ�Ӻ�1����ԭ�ӹ��ɣ�A���Ա�ʾ����ˮ�����ӣ���2��H2O�Ӻ���Ͽ��ɱ�ʾˮ�����ɱ�ʾˮ��Ԫ����ɣ���ˮ������Ԫ�غ���Ԫ����ɵģ���3��A����ˮ���������У��¶����ߣ�ˮ����֮�������A����B�����������ڲ��ϵ��˶��ģ���ˮ���������У��¶����ߣ������˶������ʸ��죬��B��ȷ��
C��ˮ���������������仯�����ӱ���û�з����ı䣬��C����
D��ˮ������ˮ���ӻ���������˶��ٶȼӿ죬ˮ����֮��ļ�����ˮ���ӵ�������䣬��D����4���ƾ������������ص�����������ˮ����ˮ���γɾ�һ���ȶ��Ļ��������γ���Һ�������Ͳ�����ˮ�����ܺ�ˮ�γɾ�һ���ȶ��Ļ����������γ���Һ����5��������п�ʹˮ�и�þ���ӻ�����ת��Ϊ�������Ӷ�����ˮ��Ӳ�ȣ�Ӳˮ�м������ˮ������ĭ�٣���ˮ�м������ˮ������ĭ�࣬�ʷ���ˮ������Ӳˮ����ˮ����6��A������ʹ�û���ũҩ����Ⱦ������ʹˮ�ܵ���Ⱦ�������ڱ���ˮ��Դ����A����
B�����Ͼɵ�����������л���Ⱦ�����͵���ˮ��Դ����B����
C��������ֳ����ˮֱ�����뽭�ӻ���Ⱦˮ��Դ����C����
D����ˮ��Դ��������ֲ���������ڱ���ˮ��Դ���������ˮ����Ⱦ����D��ȷ����7����ˮ��ͨ���������������������������ѧ��Ӧ����ʽ��2H2O ![]() 2H2��+O2����
2H2��+O2����
����ʯ����ˮ��Ӧ�����������ƣ���Ӧ�Ļ�ѧ����ʽΪ��CaO+H2O�TCa��OH��2 ��
���Դ��ǣ���1��A����2����Ԫ�غ���Ԫ�أ���3��B����4��C����5��������У�����ˮ����6��D����7����2H2O ![]() 2H2��+O2������CaO+H2O=Ca��OH��2 ��
2H2��+O2������CaO+H2O=Ca��OH��2 ��
�����㾫�������ڱ��⿼���ˮ�Ĺ��ɺ�Ӳˮ����ˮ����Ҫ�˽�ˮ�����⡢��Ԫ����ɵģ�һ��ˮ��������2����ԭ�Ӻ�1����ԭ�ӹ��ɵģ���ѧ�仯�У����ӿɷֶ�ԭ�Ӳ��ɷ֣�Ӳˮ����ˮ�ļ������÷���ˮ���и�����������ĭ���ٵ���Ӳˮ����ĭ�϶������ˮ���ܵó���ȷ�𰸣�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��Ч�������������ػ�����ȡ��ʩ���ƴ����������о�����Ч���ƿ����еĵ������̼������ĺ����Ե���Ϊ��Ҫ��
I.���������о�
��1��һ�������£���2molNO��2molO2���ں����ܱ������з�����Ӧ2NO(g)+O2(g)![]() 2NO2(g)�����и�����˵����Ӧ�ﵽƽ��״̬���� ________________������ĸ���ţ� ��
2NO2(g)�����и�����˵����Ӧ�ﵽƽ��״̬���� ________________������ĸ���ţ� ��
a����ϵѹǿ���ֲ��� b�����������ɫ���ֲ���
c��NO��O2�����ʵ���֮�ȱ��ֲ��� d��ÿ����1 molO2ͬʱ����2 molNO2
��2��������ȼ������ʱ������N2��O2�ķ�Ӧ��N2 +O2![]() 2NO���ǵ�������β���к���NO��ԭ��֮һ����T1��T2�¶��£�һ������NO�����ֽⷴӦʱN2�����������ʱ��仯����ͼ��ʾ������ͼ���жϷ�ӦN2(g)+O2(g)
2NO���ǵ�������β���к���NO��ԭ��֮һ����T1��T2�¶��£�һ������NO�����ֽⷴӦʱN2�����������ʱ��仯����ͼ��ʾ������ͼ���жϷ�ӦN2(g)+O2(g)![]() 2NO(g)����H__________0(����������������)��
2NO(g)����H__________0(����������������)��

����̼�������о�
��1������ɱ䣨����������֮���Ħ�������Բ��ƣ����ܱ���������ͼ��ʾ���ֽ�3molH2��2molCO���������У��ƶ����������VΪ2L����í���̶���A��B�㣬�����ϳɼ״��ķ�Ӧ���£�CO(g)+2H2(g)![]() CH3OH(g)��
CH3OH(g)��

�ⶨ��ͬ��������ͬʱ����ڵ�CO��ת���ʣ��õ��������ݣ�
T������ | 10min | 20min | 30min | 40min |
T1 | 20% | 55% | 65% | 65% |
T2 | 35% | 50% | a1 | a2 |
�������ϱ����ݣ���Ƚ�T1_________T2(ѡ����>������<������=��)��T2���£���30min ʱ��a1=________�����¶��µĻ�ѧƽ�ⳣ��Ϊ__________________��
��T2���£���40minʱ����ȥí���������ܷ������ã�����û�з����ƶ�������������ͨ��6molCO����ʱv(����________v(�棩(ѡ����>������<������=��)��
��2��һ�������¿��ü״���CO��Ӧ���ɴ�������CO��Ⱦ�������£���a mol/L�Ĵ�����b mol/L Ba(OH)2��Һ��������(��Ϻ���Һ����仯���Բ��ƣ�����ַ�Ӧ����Һ�д���2c(Ba2+)��c(CH3COO-)���������Һ�еĵ��ƽ���֪����Һ��pH=___________��������������ĵ��볣��Ka =____________ (�ú�a��b�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ������ƽ�ⳣ����
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | 1.8��10��5 | K1=4.3��10��7 K2=5.6��10��11 | 3.0��10��8 |
�ش��������⣺
��1����һ�����£�CH3COOH��Һ�д��ڵ���ƽ�⣺CH3COOH![]() CH3CH3COO��+H+ ��H��0 ,���з����У�����ʹ0.10mol��L��1CH3COOH��Һ��CH3COOH����̶��������_________��
CH3CH3COO��+H+ ��H��0 ,���з����У�����ʹ0.10mol��L��1CH3COOH��Һ��CH3COOH����̶��������_________��
a����������0.10mol��L��1��ϡ����
b������ c����ˮϡ����0.010mol��L��1
d���������������� e�����������Ȼ��ƹ���
f����������0.10mol��L��1��NaOH��Һ
��2��������0.1mol/L��CH3COOH��Һ��ˮϡ���̣����б���ʽ������һ����С����___________��
A��c��H+�� B��c��H+��/c��CH3COOH��
C��c��H+��c��OH���� D��c��OH����/c��H+��
��3�����Ϊ10mLpH=2�Ĵ�����Һ��һԪ��HX�ֱ��ˮϡ����1000mL��ϡ����pH�仯��ͼ����HX�ĵ���ƽ�ⳣ��_____������ڡ��������ڡ���С�ڡ��������ƽ�ⳣ����������_____________________��ϡ�ͺ�HX��Һ��ˮ���������c��H+��____������Һˮ�������c��H+��������ڡ��������ڡ���С�ڡ��������ǣ�_________________________��

��4��25��ʱ��CH3COOH��CH3COONa�Ļ����Һ������û��ҺpH=6������Һ��c��CH3COO������c��Na+��=_________________����ȷ��ֵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ĺ̶���Ҫ������;����������_______��_______��_______��������Ҫ��_______����̬���ʺ�_______��Ŀǰ������ʹ��������һ�ַ�����_______����_______��Ҫ���е����ֻ��������ϵĻ�ѧ���ϳƸ��Ϸ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����X�����о�֤��PCl5�ڹ���ʱ���ɿռ乹�ͷֱ����������������������������ӹ��ɣ����й���PCl5���ƶ���ȷ���ǣ� ��
A. PCl5 �����Ƿ��Ӿ���
B. PCl5������PCl32+ �� PCl72�� ���ɣ���������Ŀ֮��Ϊ1��1
C. PCl5����������õĵ�����
D. PCl5������PCl4+ �� PCl6�� ���ɣ���������Ŀ֮��Ϊ1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼװ���������ʵ�飺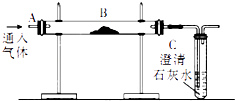
��1��̽��ȼ����������B��ʢ��ľ̿��������A��ͨ�뵪��һ��ʱ�����B�����ȣ�B��C��û�����Ա仯��
��B����ȴ�����£���A��ͨ������һ��ʱ���B��C��û�����Ա仯��
����A������ͨ��������Ȼ����B�����ȣ�����ľ̿ȼ�գ�C������ǣ�
�����Աȣ�˵��ȼ�յ�����֮һ����
�����Աȣ�˵��ȼ�յ�����֮һ�� ��
��2��ģ�ҵ��������B��ʢ����������ĩ����A��ͨ��һ����̼һ��ʱ���B���·�����Ƽ��ȣ�B���ɹ۲쵽������Ϊ �� д���÷�Ӧ�Ļ�ѧ����ʽ �� β�������ķ���Ϊ ��
��3������Ȼ����־���ء���ɫ������������������ڵ��������õ������������÷�Ӧ�Ļ�ѧ����ʽ �� �������Ӧ����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ����0.1000mol��L-1������������Һ�ζ�δ֪Ũ�ȵ����ᣬ������ɷֽ�Ϊ���¼�����
A. ȡ20.00mL����������Һע��ྻ����ƿ�в�����2��3�η�̪��Һ
B. �ñ�����������Һ��ϴ�ζ���2��3��
C. ��ʢ�б�����������Һ�ļ�ʽ�ζ��̶ܹ��ã����ڵζ��ܵļ���ʹ֮������Һ
D. ȡ������������Һע���ʽ�ζ�������0���̶�����2��3mL��
E. ����Һ������0�� ��0���̶����£����¶���
F. ����ƿ���ڵζ��ܵ����棬�ñ�����������Һ�ζ����յ㲢���µζ��ܵĶ���
�ش��������⣺
��1����ȷ�IJ���˳���ǣ�B��________________��F������ţ���
��2������B����IJ���Ŀ����________________��
��3������A�������֮ǰ�������ô���Һ��ϴ��ƿ����Եζ������Ӱ����_____���ƫ����ƫС������Ӱ�죩��
��4���жϵ���ζ��յ��ʵ������Ϊ________________��
��5�����ζ�����ʱ���ζ���Һ����ͼ��ʾ�����յ����Ϊ_________mL��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й���ϩ������������ȷ����
����ϩ����ˮ��ɵ��Ҵ� ����ϩ�����Ӿ۷�Ӧ���ɾ���ϩ �������л�����ϩ������ˮϴ����ȥ������ϩ����ɫ��������ζ��������ˮ������
A. �Т� B. �ٺ͢� C. �ں͢� D. �ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������(LiMn2O4)����Ϊ����ӵ�ص��������ϡ���ҵ���������̿����պ���������SO2 ��O2���Ʊ�����ﮣ������������£�
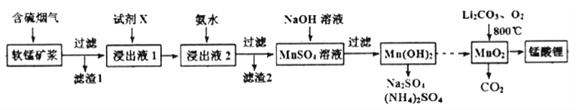
��֪�������̿���Ҫ�ɷ�ΪMnO2��������Fe2O3��FeO��Al2O3��SiO2�����ʡ�
�����̿������պ��������Ĺ�������������ǿ��
�۲����������������ص���ҺpH���±���
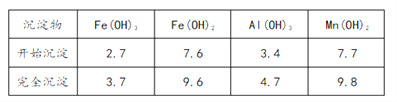
��1����֪��
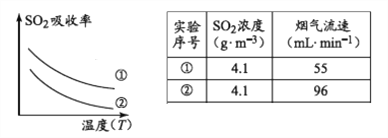
���д�ʩ�����SO2�����ʵ���__________������ţ�
a.����ͨ�뺬���������¶� b.����ͨ�뺬���������¶�
c.�������̿Ľ����� d.��Сͨ�뺬������������
��2�������Լ�X����߲�Ʒ���ȣ���X������_____________���ѧʽ��
��3���Ӱ�ˮ����ҺpH��5��6֮�䣬Ŀ����_______________��
��4������﮿ɳ���ص��ܷ�ӦʽΪ��Li1-xMnO2+LixC ![]() LiMn2O4+C(x<1)
LiMn2O4+C(x<1)
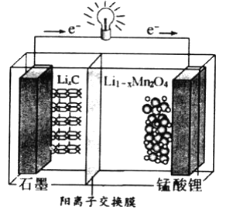
�ٷŵ�ʱ����ص�������ӦʽΪ__________________
�ڳ��ʱ����ת��1mole-����ʯī�缫������__________g��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com