


���� I����1���ڷ�Ӧ��2Cu2O��g��+Cu2S��g���T6Cu��g��+SO2��g����H=+116.0kJ•mol-1�У�ÿ����1mol��������ת�Ƶ��ӵ����ʵ���=1mol��[4-��-2��]=6mol�����ݶ��������ת�Ƶ��ӵ����ʵ�����ϵ���㣻
��2����Ӧ�٣�2Cu2S��g��+3O2��g���T2Cu2O��g��+2SO2��g����H=-768.2kJ•mol-1
��Ӧ�ڣ�2Cu2O��g��+Cu2S��g���T6Cu��g��+SO2��g����H=+116.0kJ•mol-1
������ʽ��+�ڵ�3Cu2S��g��+3O2��g��=6Cu��g��+3SO2��g������Ӧ�Ƚ�����Ӧ�ĸı䣻
II����1������Cu��OH��2����H2O������CuCO3����CO2��ˮ��ʹ��ˮ����ͭ����ɫ��������̼��ʹ����ʯ��ˮ����ǣ���������ˮ����ͭ����ˮ���ó���ʯ��ˮ���������̼��
��2���������ȷ��˵�����ɵ������к��ж�����̼��������̼��ʹ����ʯ��ˮ����ǣ���ˮ����ͭ����ɫ��
��3���������ȷ�������ɵ������к��ж�����̼��ˮ��
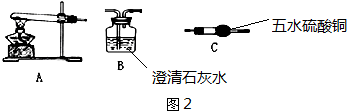
�������ӵ�װ����ʵ��ǰ�������װ�������ԣ�
��װ��C��Ũ���ᣬ������ˮ�֣�C������������Ϊˮ������������Hԭ���غ����������ͭ�������Ӷ�ȷ��̼��ͭ��������������������ʽ����̼��ͭ����������
��4��CaSO4��̼���Ʒ�Ӧת��ΪCaCO3�����ӷ���ʽΪ��CaSO4��s��+CO32-��aq��=CaCO3��s��+SO42-��aq������ƽ�ⳣ��K=$\frac{c��S{{O}_{4}}^{2-}��}{c��C{{O}_{3}}^{2-}��}$=$\frac{{K}_{sp}��CaS{O}_{4}��}{{K}_{sp}��CaC{O}_{3}��}$��
��5�����ݷ�Ӧ�����������д����ʽ��
��� �⣺I����1���ڷ�Ӧ��2Cu2O��g��+Cu2S��g���T6Cu��g��+SO2��g����H=+116.0kJ•mol-1�У�ÿ����1mol��������ת�Ƶ��ӵ����ʵ���=1mol��[4-��-2��]=6mol��n��SO2��=$\frac{11.2L}{22.4L/mol}$=0.5mol����ÿ����0.5mol��������ת�Ƶ���3mol���ʴ�Ϊ��3��
��2����Ӧ�٣�2Cu2S��g��+3O2��g���T2Cu2O��g��+2SO2��g����H=-768.2kJ•mol-1
��Ӧ�ڣ�2Cu2O��g��+Cu2S��g���T6Cu��g��+SO2��g����H=+116.0kJ•mol-1
������ʽ��+�ڵ�3Cu2S��g��+3O2��g��=6Cu��g��+3SO2��g������H=��-768.2kJ•mol-1
��+��+116.0kJ•mol-1��=-652.2kJ/mol��
�ʴ�Ϊ��3Cu2S��g��+3O2��g��=6Cu��g��+3SO2��g������H=-652.2kJ/mol��
II����1������Cu��OH��2����H2O������CuCO3����CO2��ˮ��ʹ��ˮ����ͭ����ɫ��������̼��ʹ����ʯ��ˮ����ǣ���������ˮ����ͭ����ˮ���ó���ʯ��ˮ���������̼����Ϊ����ʯ��ˮ�к���ˮ�֣�����Ӧ���ȼ���ˮ����������̼����ʵ����������˳����A��C��B���ʴ�Ϊ��A��C��B��
��2���������ȷ��˵�����ɵ������к��ж�����̼��������̼��ʹ����ʯ��ˮ����ǣ���Ϊû��ˮ��������ˮ����ͭ����ɫ������������C�й��岻��ɫ��B����Һ����ǣ��ʴ�Ϊ��C�й��岻��ɫ��B����Һ����ǣ�
��3���������ȷ�������ɵ������к��ж�����̼��ˮ��
�������ӵ�װ����ʵ��ǰ�������װ�������ԣ��ʴ�Ϊ������װ�������ԣ�
��װ��C��Ũ���ᣬ������ˮ�֣�C������������Ϊˮ��������m��H2O��=ng��n��H2O��=$\frac{ng}{18g/mol}=\frac{n}{18}$mol������Hԭ���غ��n[Cu��OH��2]=n��H2O��=$\frac{ng}{18g/mol}=\frac{n}{18}$mol����m[Cu��OH��2]=$\frac{n}{18}$mol��98g/mol=$\frac{49n}{9}$g��
m��CuCO3��=��m-$\frac{49n}{9}$��g��̼��ͭ��������=$\frac{��m-\frac{49n}{9}��g}{mg}��100%$=$\frac{9m-49n}{9m}��100%$��
�ʴ�Ϊ��$\frac{9m-49n}{9m}��100%$��
��4��CaSO4��̼���Ʒ�Ӧת��ΪCaCO3�����ӷ���ʽΪ��CaSO4��s��+CO32-��aq��=CaCO3��s��+SO42-��aq������ƽ�ⳣ��K=$\frac{c��S{{O}_{4}}^{2-}��}{c��C{{O}_{3}}^{2-}��}$=$\frac{{K}_{sp}��CaS{O}_{4}��}{{K}_{sp}��CaC{O}_{3}��}$=$\frac{9.1��1{0}^{-4}}{2.8��1{0}^{-9}}$=3.25��10-5��
�ʴ�Ϊ��3.25��10-5��
��5�����ݷ�Ӧ�����������д����ʽΪ2[2CuCO3•Cu��OH��2]+3C$\frac{\underline{\;\;��\;\;}}{\;}$6Cu+7CO2��+2H2O��
�ʴ�Ϊ��2[2CuCO3•Cu��OH��2]+3C$\frac{\underline{\;\;��\;\;}}{\;}$6Cu+7CO2��+2H2O��
���� ������Cu���仯����Ϊ���忼�����ʳɷּ��顢�������ʼ����֪ʶ�㣬�ۺ��Խ�ǿ��Ϊ��Ƶ���㣬�漰����ʽ����д��ƽ�ⳣ�����㡢����ʽ�ļ��㡢��˹���ɡ�ʵ����Ƶ�֪ʶ�㣬��ȷʵ��ԭ�����������ʡ���ѧ��Ӧԭ���ǽⱾ��ؼ����ѵ���ʵ����ƣ�֪��ÿ�����������ü����ܷ����ķ�Ӧ����Ӧ�����ؿ���ѧ��ʵ�������ʵ�������������Ŀ�Ѷ��еȣ�


 Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д�
Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д� �������Ͽ�ʱͬ��ѵ��ϵ�д�
�������Ͽ�ʱͬ��ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
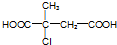 ��
�� ��R1��R4��ʾ������
��R1��R4��ʾ������ ��
��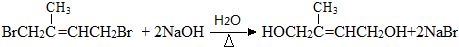 ��
�� ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ˮ���ɱ����ۻ� | B�� | ʳ�κʹ����Ƶ��ۻ� | ||
| C�� | Һ���Һ�������� | D�� | ����������ˮ�ĵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | S2Cl2�Ľṹ��ʽ��S-Cl-S-Cl | |
| B�� | 13.5g S2Cl2��NaOH��Ӧ����ת����Ϊ0.1NA | |
| C�� | S2Cl2��NaOHˮ��Һ��Ӧ�������뻹ԭ�������ʵ���֮��Ϊ1��1 | |
| D�� | S2Cl2��ˮ��Ӧ�У���������ԭ�����ʵ���֮��Ϊ1��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 44.8L | B�� | 5L | C�� | 11.2L | D�� | 33.6L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�1 mol Na2O2�к��е�����������������3NA | |
| B�� | ��״���£�2.24 L���к�C-H��ĿΪ0.6NA | |
| C�� | 3.2 g�������ͳ�����ɵĻ�����к��еķ�����ĿΪ0.1NA | |
| D�� | Cl2��NaOH��Һ��Ӧÿ����1 molNaCl��ת�Ƶ��ӵ���ĿΪ2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | v��A2��=1.5 mol/��L•s�� | B�� | v��B2��=2.4 mol/��L•s�� | C�� | v��C��=1.6 mol/��L•s�� | D�� | v��A2��=6 mol/��L•min�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2O��g���TH2��g��+$\frac{1}{2}$O2����H��298K��=-242kJmol-1 | |
| B�� | H2��g��+$\frac{1}{2}$O2��g���TH2O��l������H��298K��=+484kJmol-1 | |
| C�� | H2��g��+$\frac{1}{2}$O2��g���TH2O��g������H��298K��=-242kJmol-1 | |
| D�� | H2��g��+$\frac{1}{2}$O2��g���TH2O��g������H��298K��=-484kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cl-��OH-�����������˶���Cl-����⣬��OH-��������������������Լ��� | |
| B�� | �����ĵ缫��Ӧ�ǣ�4OH--4e-�TO2��+2H2O | |
| C�� | �������ܷ�Ӧ����ʽΪ��2Cl-+2H2O�TCl2��+H2��+2OH- | |
| D�� | ���������ֱ����2�η�̪����������������ɺ�ɫ������������ɫ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com