
| A.焦炭是铁矿石炼铁时的还原剂 | B.空气在与焦炭的反应中,为炼铁提供能量 |
| C.石灰石是助矿石中杂质形成炉渣 | D.固体原料需粉碎,增大与气体的接触面 |
 考前必练系列答案
考前必练系列答案科目:高中化学 来源:不详 题型:填空题
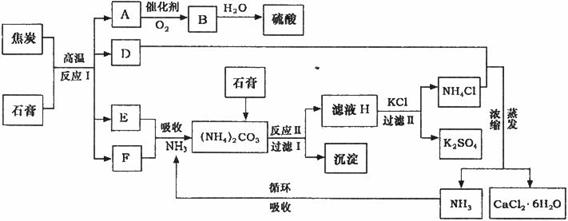
 压 强 / M Pa 压 强 / M Pa转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
 的方法是___________________________________。
的方法是___________________________________。 )是目前常用的无机储热材料,选择的依据是___________ (填序号)。
)是目前常用的无机储热材料,选择的依据是___________ (填序号)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.工业合成氨 | B.工业上用氯气制取漂白粉 |
| C.工业制硫酸 | D.实验室制取溴苯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
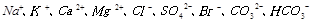 等离子。
等离子。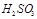 、
、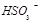 、
、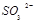 等氧化,试写出其中一个反应的方程式: 。
等氧化,试写出其中一个反应的方程式: 。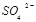 浓度与进入吸收塔的天然海水相比,
浓度与进入吸收塔的天然海水相比,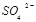 浓度 (填序号)。
浓度 (填序号)。| A.减少 | B.增大 | C.不变 | D.无法判断 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
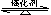 2NH
2NH 3 ⊿H<0。
3 ⊿H<0。
 件的主要原因是 。
件的主要原因是 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
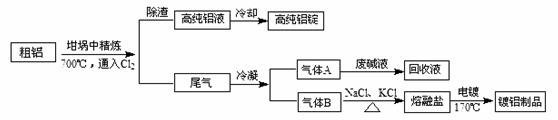
 :NaCl熔点为801℃;AlCl3在181℃升华)
:NaCl熔点为801℃;AlCl3在181℃升华)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.合成氨生产过程中将NH3液化分离,可提高N2、H2的转化率 |
| B.硫酸工业中,为了提高SO2的转化率,用五氧化二钒作催化剂, |
| C.电解饱和食盐水制烧碱采用离子交换膜法,可防阴极室产生的C12进入阳极室 |
| D.电解精炼铜时,同一时间内阳极溶解铜的质量和阴极析出铜的质量相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com