
| A. | 很早以前人们用加热胆矾或绿矾的方法制取硫酸 | |
| B. | 将氢气在氯气中燃烧生成氯化氢,然后溶于水得到盐酸,工业上常用此法制取盐酸 | |
| C. | 苏打是焙制糕点所用的发酵粉的主要成分之一,还可以用来治疗胃酸过多的一种药剂 | |
| D. | “水玻璃”是建筑行业中经常使用的一种黏合剂,同时也可用作防腐剂和防火剂 |
分析 A.加热胆矾或绿矾,可生成三氧化硫,进而与水反应生成硫酸;
B.工业可用氢气在氯气中燃烧的方法制备氯化氢;
C.苏打不能用于胃酸的治疗;
D.水玻璃具有黏性、不燃烧也不支持燃烧.
解答 解:A.加热胆矾或绿矾,可生成三氧化硫,三氧化硫与水反应生成硫酸,故A正确;
B.氢气在点燃条件下与氯气反应生成氯化氢,溶于水得到盐酸,为重要的工业制法,故B正确;
C.苏打碱性较强,具有腐蚀性,不能用于胃酸的治疗,故C错误;
D.水玻璃具有黏性、不燃烧也不支持燃烧,也用于木材的防腐,故D正确.
故选C.
点评 本题综合考查元素化合物知识,为高频考点,侧重考查学生的分析能力以及元素化合物知识的综合了解和运用,有利于培养学生良好的科学素养,难度不大.


科目:高中化学 来源: 题型:实验题
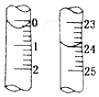 某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:
某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1=Q2=197 | B. | Q1=Q2<197 | C. | Q1<Q2<197 | D. | Q2<Q1<197 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取溴苯:将铁屑、溴水、苯混合加热 | |
| B. | 等物质的量的甲烷和乙酸完全燃烧消耗氧气的量相等 | |
| C. | 把溴水分别加到足量NaOH溶液和己烯中,充分反应后溶液都呈无色,所以不能用溴水鉴别这两种物质 | |
| D. | 检验某溶液中是否含有乙醛:在盛有2 mL 10%CuSO4溶液的试管中滴加0.5mL10%NaOH溶液,混合均匀,滴入待检液,加热,看是否产生砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中Cl2发生还原反应 | |
| B. | 该反应中S2O32-为还原剂,Cl-为还原产物 | |
| C. | 脱氯反应后,溶液的酸性增强 | |
| D. | SO2与氯气的漂白原理相同,所以也可以用SO2作纺织工业的漂白剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com