
| 编号 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A. | CO2 (g) | SO2(g) | 饱和Na2CO3溶液、浓H2SO4 | 洗气 |
| B. | NaCl(s) | KNO3(s) | AgNO3溶液 | 过滤 |
| C. | 苯 | 苯酚 | 浓溴水 | 过滤 |
| D. | 苯 | 甲苯 | KMnO4(酸化),NaOH溶液 | 分液 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
| A、钡中毒患者可尽快使用苏打溶液洗胃,随即导泻使Ba2+转化为BaCO3而排出 |
| B、工业上可以用NaHS、(NH4)2S等可溶性硫化物作沉淀剂除去废水中的Hg2+ |
| C、水中的Mg(HCO3)2、Ca(HCO3)2受热易分解生成难溶性的MgCO3、CaCO3,故水垢的主要成分是MgCO3、CaCO3 |
| D、珊瑚虫从周围海水中获取Ca2+和HCO3-,经反应形成石灰石(CaCO3)外壳,从而逐渐形成珊瑚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、R为前四周期元素,且原子序数依次增大.常温下X的氢化物XH3溶于水PH>7;Y是地壳里含量最多的金属元素,其单质与酸碱均能反应;Z2有毒,其水溶液有漂白性;R基态原子3d轨道的电子数是4S轨道的电子数的3倍,RZ2溶液呈浅绿色.回答下列问题:
X、Y、Z、R为前四周期元素,且原子序数依次增大.常温下X的氢化物XH3溶于水PH>7;Y是地壳里含量最多的金属元素,其单质与酸碱均能反应;Z2有毒,其水溶液有漂白性;R基态原子3d轨道的电子数是4S轨道的电子数的3倍,RZ2溶液呈浅绿色.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
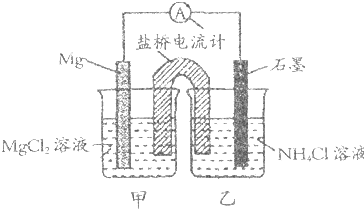
| A、石墨电极反应式为2NH4++2e-=2NH3↑+H2↑ |
| B、乙烧杯中一直存在:c(Cl-)<c(NH4+) |
| C、电子流向是由石墨→导线→Mg |
| D、盐桥中的Cl-移向乙烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏法是除去水中杂质得到纯净的水的最好方法 |
| B、用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 |
| C、用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
| D、用加热、蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当x=0.2,则混合溶液中y可能大于7或小于7 |
| B、当x=0.2,y=1,则混合溶液中:c(H+)=c(A2-)+c(OH-) |
| C、当x=0.3,y>7,则混合溶液中:c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+) |
| D、当x=0.4,则混合溶液中:[c(Na+)+c(H+)]>2c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| 气体 | CO2 | H2 | CO | H2O |
| 浓度(mol/L) | 0.1 | 0.9 | 0.3 | 0.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量浓度相等的溶液pH关系:pH(NaClO)>pH(Na2CO3)>pH(CH3COONa) |
| B、向NaClO溶液中通少量CO2:CO2+NaClO+H2O→NaHCO3+HClO |
| C、a mol/L HClO与b mol/L NaOH溶液等体积混合后所得溶液中c(Na+)>c(ClO-),则a一定小于b |
| D、向氯水中加入NaHCO3固体,可以增大氯水中次氯酸的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com