

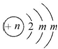
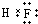 ;A的最高价氧化物对应水化物的化学式为HNO3.
;A的最高价氧化物对应水化物的化学式为HNO3.分析 A、B、C为短周期元素,根据这几种元素在周期表中的位置知,A和C位于第二周期、B位于第三周期,B2-的结构示意图为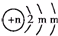 ,第二电子层上最多排列8个电子,所以m=8,B核内质子数=2+8+8-2=16,所以B是S元素;A、C两种元素的原子核外电子数之和等于B原子的质子数,结合三种元素的位置知,A是N元素、C是F元素,再结合物质的性质分析解答.
,第二电子层上最多排列8个电子,所以m=8,B核内质子数=2+8+8-2=16,所以B是S元素;A、C两种元素的原子核外电子数之和等于B原子的质子数,结合三种元素的位置知,A是N元素、C是F元素,再结合物质的性质分析解答.
解答 解:A、B、C为短周期元素,根据这几种元素在周期表中的位置知,A和C位于第二周期、B位于第三周期,B2-的结构示意图为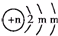 ,第二电子层上最多排列8个电子,所以m=8,B核内质子数=2+8+8-2=16,所以B是S元素;A、C两种元素的原子核外电子数之和等于B原子的质子数,结合三种元素的位置知,A是N元素、C是F元素,
,第二电子层上最多排列8个电子,所以m=8,B核内质子数=2+8+8-2=16,所以B是S元素;A、C两种元素的原子核外电子数之和等于B原子的质子数,结合三种元素的位置知,A是N元素、C是F元素,
(1)通过以上分析知,A为N,B为S,C为F,
故答案为:N;S;F;
(2)B为S元素,S原子核外有3个电子层、最外层电子数是6,所以B位于周期表中第三周期VIA族,
故答案为:三;VIA;
(3)C为F,C的氢化物的电子式为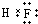 ,A的最高价氧化物对应水化物是硝酸,其化学式为HNO3,
,A的最高价氧化物对应水化物是硝酸,其化学式为HNO3,
故答案为: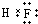 ;HNO3;
;HNO3;
(4)B为S,C为F,已知SF6在温度高于45度时为气态,SF6属于共价化合物,
故答案为:共价.
点评 本题考查位置、结构与性质关系的综合应用,题目难度不大,根据原子结构及元素在周期表中的位置确定元素,再结合元素周期律来分析解答,注意掌握原子结构与元素周期律、元素周期表的关系,试题有利于提高学生的分析能力及逻辑推理能力.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:选择题
| A. | 向硫酸铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 少量双氧水滴入酸性KI溶液:2H2O2+2I-+4H+═4H2O+I2 | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| D. | 碱性锌锰电池正极反应:2MnO2+2H2O+2e-═2MnOOH+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
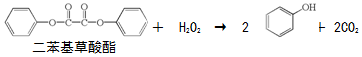
| A. | 上述反应是酯的水解反应 | |
| B. | 荧光棒发光过程涉及化学能到光能的转化 | |
| C. | 二苯基草酸酯苯环上的一氯代物共有4种 | |
| D. | 二苯基草酸酯与草酸( 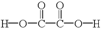 )互为同系物 )互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若卤代烃的分子式为C4H9X,则RCH2X有5种结构 | |
| B. | 该反应是置换反应 | |
| C. | 反应过程中RCH2X是氧化剂 | |
| D. | 处理含1 mol卤代烃的废水时,转移4 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
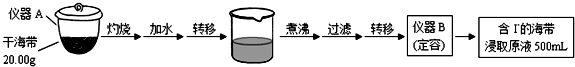
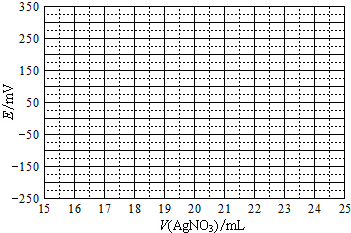
| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
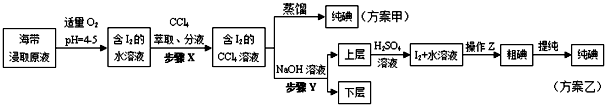
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s22s1 | B. | 1s22s12p1 | C. | 1s22s22p63s2 | D. | 1s22s22p63s1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学只研究自然界中存在的物质 | |
| B. | 化学的特征是认识分子和制造分子 | |
| C. | 通过化学方法可以制造出使人长生不老的“仙丹” | |
| D. | 化学的研究层面越来越广,原子核的变化也已成为化学研究的范畴 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
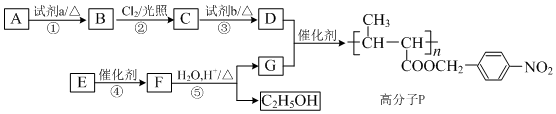
 ,
, +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$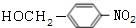 +NaCl.
+NaCl.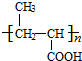 .
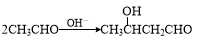
.
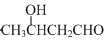 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 盐酸是一种非常重要的化工原料,在工业上和实验室中有着广泛的应用.
盐酸是一种非常重要的化工原料,在工业上和实验室中有着广泛的应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com