考点:化学平衡状态的判断,用盖斯定律进行有关反应热的计算,化学电源新型电池,化学平衡常数的含义
专题:化学反应中的能量变化,化学平衡专题,电化学专题
分析:(1)达到平衡状态时,正逆反应速率相等,各物质的浓度不变,以此判断;
(2)先计算出用氮气表示的反应速率,然后利用化学计量数关系计算出用氢气表示的反应速率;
(3)计算出反应前氮气、氢气的物质的量浓度,然后利用化学平衡三段式计算出达到平衡时各组分的浓度,最后根据化学平衡常数表达式计算出该温度下的平衡常数;
(4)先将丙中的数据按照化学计量数转化成反应物氮气、氢气的物质的量,然后利用等效平衡知识进行分析;
(5)①根据氧化还原反应反应方程式中氧化剂化合价降低,反应中被还原分析该反应中的氧化剂;
②依据热化学方程式和盖斯定律计算出该反应的焓变;
(6)碱性电解质,负极发生氧化反应.
解答:
解:(1)a.容器内N
2、H
2、NH
3的浓度之比为1:3:2,不能说明达到判断状态,取决于起始配料比和转化程度,故a错误;
b.当3v(N
2)
正=v(H
2)
逆时,才说明达到平衡状态,故b错误;
c.容器内压强保持不变,可说明达到平衡状态,故c正确;
d.恒容时体积不变,质量不变,则混合气体的密度保持不变,不能达到平衡状态,故d错误.
故答案为:c;
(2)容器乙中,反应前氮气的浓度为:
=2mol/L,氮气的平均反应速率为:v(N
2)=
=0.1mol?L
-1?min
-1,根据反应3H
2(g)+N
2(g)?2NH
3(g)可知:v(H
2)=3v(N
2)=0.3 mol?L
-1?min
-1,
故答案为:0.3 mol?L
-1?min
-1;
(3)甲容器中,反应前氢气浓度为:c(H
2)=
=1.5mol/L,氮气的浓度为:
=1mol/L,达到平衡时氮气的浓度变化为:(1-c
1)mol/L,
由化学平衡的三段式可得:
3H
2(g)+N
2(g)?2NH
3(g)
反应前(mol/L):1.5 1 0
浓度变化:(mol/L):3(1-c
1) (1-c
1) 2(1-c
1)
反应后:(mol/L):1.5-3(1-c
1) 1-(1-c
1) 2(1-c
1)
在该温度下甲容器中反应的平衡常数K=
,
故答案为:
;
(4)恒温、恒容条件下:
a.假设乙容器的容积为4L,则达到平衡时甲乙为等效平衡,各组分的含量、浓度相等,此时氮气的浓度为c
1,然后将容器的容积缩小到2L,若平衡不移动,2c
1=1.5mol/L,由于压强增大,平衡向着正向移动,氨气的浓度增大,所以2c
1>1.5mol/L,故a正确;
b.反应前后都是气体,容器的容积都是2L,乙中混合气体的质量为甲的2倍,根据
ρ=可知:2ρ
1=ρ
2,故b正确;
c.丙中2mol氨气相当于加入了1mol氮气、3mol氢气,而甲中为3mol H
2、2mol N
2,由于丙反应物氮气的物质的量减小,生成的氨气的物质的量减小,所以ω
3<ω
1,故c错误;
d.K
甲=K
乙=K
丙,温度相同,K值相同,故d正确;
故选abd;
(5)①反应CO(NH
2)
2+NO+NO
2=CO
2+2N
2+2H
2O中,化合价升高和降低的都是氮元素,其中NO、NO
2中的氮元素化合价降低,被还原,在反应中作氧化剂,
故答案为:NO、NO
2;
②已知:①N
2(g)+O
2(g)=2NO(g)△H=a kJ?mol
-1②N
2(g)+3H
2(g)=2NH
3(g)△H
2=b kJ?mol
-1③2H
2(g)+O
2(g)=2H
2O(g)△H=c kJ?mol
-1依据盖斯定律③×3-2×②-2×①得到,4NO(g)+4NH
3(g)+O
2(g)═4N
2(g)+6H
2O(g)△H=(3c-2a-2b)kJ/mol,故答案为:(3c-2a-2b);
(6)氨气为碱性气体,易与酸反应,所以电解质溶液应呈碱性,负极发生氧化反应,氨气被氧化生产氮气,电极反应式为2NH
3-6e
-+6OH
-=N
2+6H
2O,
故答案为:碱性;2NH
3-6e
-+6OH
-=N
2+6H
2O.
点评:本题考查化学平衡、电化学,盖斯定律的运用等知识,题目难度中等,本题影响化学平衡的因素,把握电极反应式的书写.





 与
与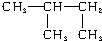 ④O2和O3 ⑤氯水和氯气
④O2和O3 ⑤氯水和氯气